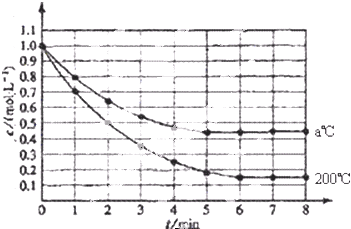
题目内容
【题目】亚氯酸钠(NaClO2)是一种应用广泛的氧化剂和漂白剂。
(1)亚氯酸钠(NaClO2)中氯元素的化合价是____________;
(2)某同学通过查阅文献发现:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。该同学利用下图所示装置制取NaClO2晶体:
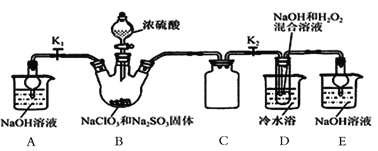
①装置B中盛装浓硫酸的仪器名称是______,装置C的作用是_________;
②已知装置B中的产物有ClO2气体,装置B中反应的化学方程式为___________________;
③装置D中发生反应的化学方程式为______________________________,反应后的溶液中除了ClO2-、ClO3-、Cl-、ClO-、OH-外还可能含有一种阴离子是_____,检验该离子的方法是_____________;
④反应结束后,先将装置D反应后的溶液在55℃条件下减压蒸发结晶,然后趁热过滤,再用38℃~60℃的温水洗涤,最后在低于60℃条件下干燥,得到NaClO2晶体。如果撤去装置D中的冷水浴,可能导致产品中混有的杂质是______________________;
【答案】 +3 分液漏斗 防止倒吸 2NaClO3+Na2SO4+H2SO4=2ClO2+2Na2SO4+H2O 2ClO2+H2O2+2NaOH= 2NaClO2+O2+H2O SO42- 取反应后的溶液少许置于试管中,滴加几滴BaCl2溶液,若有白色沉淀出现,则含有SO42- NaClO3 和NaCl
【解析】(1)由化合价代数和为0,Na是+1价,氧为-2价,亚氯酸钠(NaClO2)中氯元素的化合价是+3价。(2)①装置B中盛装浓硫酸的仪器名称是分液漏斗,装置C的作用是防止倒吸。②氯酸钠在酸性溶液中氧化亚硫酸钠为硫酸钠,本身被还原为二氧化氯,装置B中反应的化学方程式为2NaClO3+Na2SO4+H2SO4=2ClO2+2Na2SO4+H2O;③装置D中发生反应的化学方程式为2ClO2+H2O2+2NaOH= 2NaClO2+O2+H2O,B中产生部分SO2,被氧化成SO42―,检验方法:取反应后的溶液少许置于试管中,滴加几滴BaCl2溶液,若有白色沉淀出现,则含有SO42-;④高于60℃时NaClO2分解成NaClO3和NaCl,,如果撤去装置D中的冷水浴,可能导致产品中混有的杂质是NaClO3 和NaCl。