题目内容
1.下列叙述正确的是( )| A. | 在氧化还原反应中,金属单质一定是还原剂,非金属单质一定是氧化剂 | |
| B. | 某元素在化学反应中,由化合态变为游离态,则该元素一定被还原 | |
| C. | 在氧化还原反应中,氧化剂和还原剂可能是同一种物质 | |
| D. | 有单质生成的反应一定是氧化还原反应 |
分析 A.非金属单质在反应中可能得到或失去电子,而金属单质在反应中一定失去电子;
B.由化合态变为游离态,可能得到或失去电子;
C.同种物质可能得到也同时失去电子;
D.有单质生成的反应,不一定存在元素的化合价变化.
解答 解:A.非金属单质在反应中可能得到或失去电子,如氯气与水的反应中氯气为氧化剂也为还原剂,而金属单质在反应中一定失去电子,金属只能为还原剂,故A错误;
B.由化合态变为游离态,可能得到或失去电子,如发生Fe+Cu2+=Fe2++Cu,则被还原,如发生Cl2+S2-=2Cl-+S,则被氧化,故B错误;
C.同种物质可能得到也同时失去电子,如氯气与水的反应中氯气为氧化剂也为还原剂,故C正确;
D.有单质生成的反应,不一定存在元素的化合价变化,如金刚石与石墨的转化为非氧化还原反应,故D错误;
故选C.
点评 本题考查氧化还原反应,为高频考点,把握氧化还原反应的特征及反应中元素的化合价变化为解答的关键,侧重基本概念的考查,注意结合实例解答,题目难度不大.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
12.“AD钙奶”中的“钙”指的是( )
| A. | 单质 | B. | 元素 | C. | 原子 | D. | 分子 |
16.在泡沫制作过程中,有反应2H2O2═2H2O+O2↑,下列说法正确的是( )
| A. | H2O2既是氧化剂又是还原剂 | B. | H2O2是氧化剂 | ||
| C. | O2既是氧化产物又是还原产物 | D. | 该反应转移4mole- |
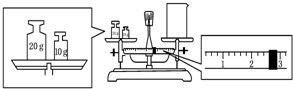 实验室欲用NaOH固体配制1.0mol•L-1的NaOH溶液250mL:
实验室欲用NaOH固体配制1.0mol•L-1的NaOH溶液250mL: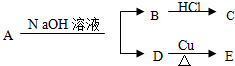 ,又已知D不与Na2CO3溶液反应,C和E都不能发生银镜反应.A的结构可能有( )
,又已知D不与Na2CO3溶液反应,C和E都不能发生银镜反应.A的结构可能有( )

 .
. ,
, .
. .
. )发生酯化反应而生成的,写出F→G的反应的化学方程式CH2=C(CH3)COOCH2CH2OH+
)发生酯化反应而生成的,写出F→G的反应的化学方程式CH2=C(CH3)COOCH2CH2OH+