题目内容
9.密闭容器中放有H2S和O2的混合气体,加热至493K后点燃,反应结束后温度降至493K,测得容器中压强为反应前的71.4%,再向此容器中通入80g O2,点燃使之反应,并达到完全燃烧,反应结束后温度仍恢复到493K,测得容器中压强为最初的1.43倍,此时容器中还有O2(设此体系中不会生成SO3),原容器中H2S与O2的物质的量各是多少?(各计算步骤必须加以说明)分析 H2S与O2的反应为:①氧气不足,硫化氢过量时:2H2S+O2点燃_点燃–––––2S+2H2O,②氧气部分过量时:2H2S+O2点燃_点燃–––––2S+2H2O、S+O2点燃_点燃–––––SO2,③氧气有剩余时:2H2S+3O2点燃_点燃–––––2SO2+2H2O,
根据pV=nRT可知,容积、温度一定时压强与物质的量成正比,该温度下水为气态,
当只按照反应①进行时,则反应后压强为反应前的:2323×100%=66.67%<71.4%,当反应按照③进行反应时,则反应后压强是反应前的:4545×100%=80%>71.4%,说明开始时氧气不足,反应按照反应①或②进行;
设原混合气体中含有硫化氢xmol,含有氧气ymol,
(一)当只发生反应①且恰好反应时,反应后气体为硫化氢和水,根据反应可知,生成水的体积等于硫化氢的体积,则硫化氢的物质的量为71.4%(x+y),
第二步加入80g氧气(2.5mol)后主要发生反应:2H2S+3O2点燃_点燃–––––2SO2+2H2O、S+O2点燃_点燃–––––SO2,
第一步反应剩余的硫化氢为(x-2y),发生反应后气体的物质的量减少了:1212(x-2y)mol,根据差量法通入氧气反应结束后气体总物质的量增加了:2.5mol-0.5(x-2y)mol=(1.43-71.4%)(x+y)mol,结合x=71.4%(x+y)计算即可;
(二)反应后压强为反应前的66.67%,而实际上为71.4%,反应②的S+O2点燃_点燃–––––SO2反应中反应前后气体体积不变,说明参与该反应的氧气占有的压强为:71.4%-66.67%=4.73%,
第二步加入80g氧气(2.5mol)后主要发生反应:S+O2点燃_点燃–––––SO2,反应后气体总体积不变,则加入2.5mol氧气引起的压强变化为:1.43-71.4%=0.716,所以该容器中1mol气体所占有的压强为:0.7162.50.7162.5=0.2864,
则反应前硫化氢和氧气的总物质的量为:10.286410.2864mol=3.49mol,第一步反应过后过量的氧气所占的压强为0.0473,过量的氧气的物质的量为:0.04730.28640.04730.2864mol=0.165mol,
硫化氢与氧气发生反应2H2S+O2点燃_点燃–––––2S+2H2O的总物质的量为:3.49mol-0.165mol=3.325mol,再结合反应方程式计算出原混合气体中硫化氢和氧气的物质的量.
解答 解:硫化氢与氧气的反应有:①氧气不足,硫化氢过量时:2H2S+O2点燃_点燃–––––2S+2H2O,②氧气部分过量时:2H2S+O2点燃_点燃–––––2S+2H2O、S+O2点燃_点燃–––––SO2,③氧气有剩余时:2H2S+3O2点燃_点燃–––––2SO2+2H2O,
根据pV=nRT可知,容积、温度一定时压强与物质的量成正比,该温度下水为气态,
当只按照反应①进行时,则反应后压强为反应前的:2323×100%=66.67%<71.4%,当反应按照③进行反应时,则反应后压强是反应前的:4545×100%=80%>71.4%,
说明开始时氧气不足,反应按照反应①或②进行;
设原混合气体中含有硫化氢xmol,含有氧气ymol,
(一)当只发生反应①且恰好反应时,反应后气体为硫化氢和水,根据反应可知,生成水的体积等于硫化氢的体积,则硫化氢的物质的量为71.4%(x+y),
第二步加入80g氧气(2.5mol)后主要发生反应:2H2S+3O2点燃_点燃–––––2SO2+2H2O、S+O2点燃_点燃–––––SO2,
第一步反应剩余的硫化氢为(x-2y),发生反应后气体的物质的量减少了:1212(x-2y)mol,根据差量法通入氧气反应结束后气体总物质的量增加了:2.5mol-0.5(x-2y)mol=(1.43-71.4%)(x+y)mol,结合x=71.4%(x+y)解得:x=2.27mol、y=0.907mol;
(二)反应后压强为反应前的66.67%,而实际上为71.4%,反应②的S+O2点燃_点燃–––––SO2反应中反应前后气体体积不变,说明参与该反应的氧气占有的压强为:71.4%-66.67%=4.73%,
第二步加入80g氧气(2.5mol)后主要发生反应:S+O2点燃_点燃–––––SO2,反应后气体总体积不变,则加入2.5mol氧气引起的压强变化为:1.43-71.4%=0.716,
所以该容器中1mol气体所占有的压强为:0.7162.50.7162.5=0.2864,
则反应前硫化氢和氧气的总物质的量为:10.286410.2864mol=3.49mol,
第一步反应过后过量的氧气所占的压强为0.0473,过量的氧气的物质的量为:0.04730.28640.04730.2864mol=0.165mol,
硫化氢与氧气发生反应2H2S+O2点燃_点燃–––––2S+2H2O的总物质的量为:3.49mol-0.165mol=3.325mol,其中氧气的物质的量为:3.326mol×1313=1.108mol,硫化氢的物质的量为:3.326mol×2323=2.217mol,
则原混合气体中硫化氢的物质的量为:2.217mol,氧气为:1.108mol+0.165mol=1.273mol,
答:原混合气体中含有2.27mol硫化氢、0.907mol氧气或2.217mol硫化氢、1.273mol氧气.
点评 本题考查了讨论法在化学计算中的应用,题目难度较大,明确发生反应原理为解答关键,注意掌握讨论法在化学计算中的应用方法,试题培养了学生的分析理解能力及化学计算能力.

| A. | 巴豆酸的官能团是:碳碳双键、羧基 | |
| B. | 纯碱溶液、溴水、乙醇、酸高锰酸钾溶液均可与巴豆酸反应 | |
| C. | 巴豆酸的化学式为C4H6O | |
| D. | 巴豆酸与丁酸互为同分异构体 |
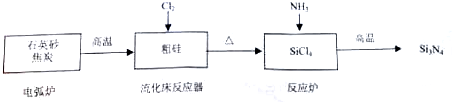
(1)①电弧炉中发生的主要化学反应方程式是SiO2+2C高温_高温–––––Si(粗硅)+2CO↑.
②用石英砂和焦炭在电弧炉中高温加热也可以生产碳化硅,该反应的化学方程式为:SiO2+3C高温_SiC+2CO↑,碳化硅俗称金刚砂,具有金刚石结构.
(2)在流化床反应的产物中,SiCl4大约占85%,还有Cl2等,有关物质沸点数据如下表:
| 物质 | Si | SiCl4 | Cl2 |
| 沸点/℃ | 2355 | 57.6 | -34.1 |
A.略小于-34.1℃B.大于57.6℃C.略小于57.6℃D.-34.1℃
(3)①粉末状Si3N4遇水能生成刺激性气味,常用于做制冷剂的气体和一种难溶性的酸,该反应的化学方程式是Si3N4+9H2O=4NH3↑+3H2SiO3↓.
②该合成氨化硅工艺流程中涉及的主要反应属于氧化还原反应的有2个.
| A. | 钠是银白色、有一定延展性的金属,硬度很大 | |
| B. | 将钠放在石棉网用酒精灯加热,钠剧烈燃烧,产生黄色火焰,生成过氧化钠 | |
| C. | 金属钠在空气中燃烧,因氧气浓度低,生成氧化钠 | |
| D. | 钠保存在煤油中,也可保存在CCl4中 |
| A. | 1mol Na2O2固体中含有O22- 2NA | |
| B. | 常温常压下,3.2g CH4中含有电子2NA | |
| C. | 标准状况下,11.2L CH3CH2OH中含有分子0.5NA | |
| D. | 100mL 1mol•L-1的CH3COOH溶液中含有CH3COOH分子0.1NA |
| A. | 在氧化还原反应中,金属单质一定是还原剂,非金属单质一定是氧化剂 | |
| B. | 某元素在化学反应中,由化合态变为游离态,则该元素一定被还原 | |
| C. | 在氧化还原反应中,氧化剂和还原剂可能是同一种物质 | |
| D. | 有单质生成的反应一定是氧化还原反应 |
| A. | 10g重水(2H216O)中含有的中子数目为5NA | |
| B. | 28g氮气所含有的原子数目为NA | |
| C. | 标准状况下,2.24L水中含有的水分子数目为0.1NA | |
| D. | 1mol铁与足量稀盐酸反应转移的电子数目为3NA |
| 元素编号 | 元素性质或原子结构 |
| T | M层的电子数是原子核外电子层数的2倍 |
| X | 原子最外层电子数是次外层的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正化合价是+7价 |
(2)元素X的一种同位素可用于测定文物年代,这种同位素的符号是146C;
(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b(填字母);
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物对应的水化物中,其中一种在水中电离程度明显不同于其他三种的是H2CO3(填化学式).