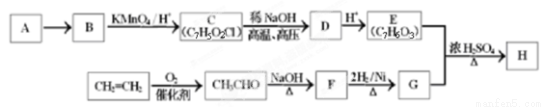
题目内容
将一小块金属钠投入到盛有100ml AlCl3和MgCl2的混合溶液的烧杯中,发现烧杯中有气泡产生,在这过程中还看到烧杯中有白色沉淀产生,沉淀物先多后少。反应完毕后,收集到标准状况下氢气13.44L同时得到21.4g沉淀,将沉淀溶于过量的NaOH溶液中,发现沉淀减少了15.6g,求原混合溶液中Mg2+、Al3+及Cl-的物质的量浓度。
Mg2+:1mol/L Al3+:3mol/L Cl-:11mol/L
【解析】
试题分析:根据2Na+2H2O—→2NaOH+H2↑,n(H2)= =0.6mol;n(Na)= n(NaOH)=1.2mol。
=0.6mol;n(Na)= n(NaOH)=1.2mol。
得到21.4g沉淀,将沉淀溶于过量的NaOH溶液中,发现沉淀减少了15.6g,说明Mg(OH)2是21.4g-15.6g=5.8g,n(Mg2+)=n[Mg(OH)2]=0.1mol,c(Mg2+)=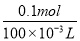 =1mol·L-1。0.1molMg2+需要0.2molNaOH。
=1mol·L-1。0.1molMg2+需要0.2molNaOH。
沉淀减少了15.6g,是Al(OH)3,为0.2mol,由反应Al(OH)3+NaOH—→NaAlO2+2H2O,此时加入0.2mol NaOH。这个实验可视为共加入1.4molNaOH。其中使全部Al3+变为NaAlO2的是1.2mol,由反应:Al3++4OH-—→AlO2-+2H2O可知,n(Al3+)=0.3mol,故c(Al3+)=3mol·L-1。
根据电荷守恒:c(Cl-)=3c(Al3+)+2 c(Mg2+)=11mol·L-1。
考点:化学反应的有关计算。考查Al3+、Mg2+在碱溶液中的反应。

练习册系列答案
相关题目