题目内容
金属是一种重要的材料,人类的生产和生活离不开金属,下表表示了金属活动顺序表中铜、铁、锡、铝元素被人类大规模开发利用的大致年代。

33. 根据图中数据和有关化学知识,你认为金属大规模开发利用的先后顺序跟______有关(填写编号)。
a. 金属的导热性 b. 金属元素在地壳中的含量
c. 金属的活动性顺序 d. 金属的延展性
34. 钢铁的生产和使用是人类文明和进步的重要标志之一,请用化学方程式表示高炉炼铁的原理___________________________________________。
35. 比较铝、铁的活泼性,可用一个实验事实说明:__________________________________;
但是铝在空气中却表现出很强的抗氧化性,其原因是____________________________。
36. 复方氢氧化铝可以治疗胃酸过多,也能与强碱溶液反应, 写出氢氧化铝的电离方程式___________________________________________________________。
33. c (1分)
34. Fe2O3+3CO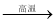 2Fe+3CO2 (1分)
2Fe+3CO2 (1分)
35. 相同形状大小的铝片和铁片放入相同浓度的盐酸中,观察气泡产生的速度,如铝片上产生气泡的速度快,说明铝比铁活泼。(合理即给分,1分)
铝表面形成致密的氧化膜,隔绝空气与内部的铝接触。 (1分)
36. AlO2—+ H+ +H2O Al(OH)3
Al(OH)3 Al3+ + 3OH— (2分)
Al3+ + 3OH— (2分)
【解析】
试题分析:33.金属大规模开发利用的先后顺序跟金属的活动性顺序有关。
34.高炉炼铁的原理Fe2O3+3CO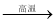 2Fe+3CO2。
2Fe+3CO2。
35.金属的活泼性可以与酸反应的速率来判断:相同形状大小的铝片和铁片放入相同浓度的盐酸中,观察气泡产生的速度,如铝片上产生气泡的速度快,说明铝比铁活泼。因铝表面有一层致密的氧化膜,故铝在空气中却表现出很强的抗氧化性。
36氢氧化铝的电离方程式是AlO2—+ H+ +H2O Al(OH)3
Al(OH)3 Al3+ + 3OH—。
Al3+ + 3OH—。
考点:金属的冶炼、金属性质的活泼比较、Al(OH)3的电离方程式。

 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案