题目内容
某金属M的氢氧化物的水合晶体[M(OH)2?xH2O]与Na2CO3混合物共36.800g,加入足量的水后,生成MCO3的白色沉淀,将沉淀滤出,洗净烘干,其质量为9.850g。
47. 将 9.850g MCO3高温灼热至恒重,得到7.650g MO固体,则产生CO2气体_______mol。
48.滤液与酸作用不产生气体;若用足量的铵盐与滤液共热,则产生4.48L气体(标准状况),滤液中OH‑的物质的量为_______mol。
49.M的相对原子质量为_________;试通过计算确定M(OH)2?xH2O中x的值:
47. 0.05(2分)。
48. 0.2mol(2分)。
49. 137(3分);8(3分)。
【解析】
试题分析:47. 将 9.850g MCO3高温灼热至恒重,得到7.650g MO固体,则产生CO2气体9.850g-7.650g=2.200g,即0.05mol。
48.M(OH)2+Na2CO3→MCO3↓+2NaOH,滤液与酸作用不产生气体,说明不含碳酸盐;足量的铵盐与滤液共热,NH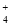 +OH-→NH3↑+H2O,产生标准状况4.48L气体,即0.2mol,滤液中OH‑的物质的量为0.2mol。
+OH-→NH3↑+H2O,产生标准状况4.48L气体,即0.2mol,滤液中OH‑的物质的量为0.2mol。
49.由MCO3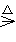 MO,0.05mol MCO3是9.850g,故(Mr+60)×0.05=9.850,Mr=137。
MO,0.05mol MCO3是9.850g,故(Mr+60)×0.05=9.850,Mr=137。
由此可知36.800g混合物中含有0.2mol M(OH)2?xH2O、0.05mol Na2CO3:
0.2×(197+18x)+0.05×106=36.800,x=8。
考点:有关化学反应方程式的计算。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案(本题共15分)
有4种质量比可能相同或不同的镁铝合金样品①、②、③、④。甲、乙、丙、丁4位同学各取1种样品,进行下列实验,测定合金中镁的质量分数。
52.甲同学取样品①m1 g和过量的氢氧化钠溶液反应,然后过滤;再往滤液中通入过量的二氧化碳气体,将所得沉淀过滤、洗涤、烘干、灼烧,得到固体质量仍为m1 g。则样品①合金中镁的质量分数为_____________。
53.乙同学取样品②m2 g和足量的盐酸反应,然后滴加过量的氢氧化钠溶液,将沉淀过滤、洗涤、烘干、灼烧,得到固体质量仍为m2 g。则样品②合金中镁的质量分数为____________。
54.丙同学取样品③m3 g和足量的稀硫酸反应,发现固体完全溶解,标准状况下得到气体体积为V L,则样品③中m3的取值范围是___________________________________________。
丁同学取不同质量的样品④分别和30 mL同浓度的盐酸反应,所取合金质量与产生气体体积(已转化为标准状况)如下:
实验序号 | a | b | c |
合金质量/mg | 510 | 765 | 918 |
气体体积/mL | 560 | 672 | 672 |
55.通过计算求该盐酸的物质的量浓度。
56.通过计算求样品④中合金中镁的质量分数。
57.在c组实验后,还需向容器中加入1.0 mol·L-1的氢氧化钠溶液多少毫升才能使剩余合金中的铝恰好完全溶解?
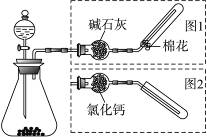
下图是实验室制取气体的装置,其中发生装置相同,干燥和集气装置有两套,分别用图1和图2表示。下列选项中正确的是
选项 | 发生装置中的药品 | 干燥和集气装置 |
A | 电石和饱和食盐水 | 图2 |
B | 大理石和稀盐酸 | 图1 |
C | 铜和稀硝酸 | 图2 |
D | 氧化钙和浓氨水 | 图1 |