题目内容
1.下列各组物质中,化学键类型和化合物类型都相同的是( )| A. | CO2和Na2CO3 | B. | SO2和H2O | C. | KOH和NaCl | D. | NaCl和HCl |
分析 一般来说,活泼金属和活泼非金属元素易形成离子键,非金属元素之间易形成共价键;含离子键的一定为离子化合物,以此来解答.
解答 解:A.CO2中只含C、O之间形成的共价键,为共价化合物,而Na2CO3中含离子键和共价键,为离子化合物,故A不选;
B.二者均只含共价键,均为共价化合物,故B选;
C.KOH中含离子键和共价键,NaCl中只含离子键,故C不选;
D.NaCl为含离子键的离子化合物,HCl为含共价键的共价化合物,故D不选;
故选B.
点评 本题考查化学键,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,注意含离子键的化合物一定为离子化合物,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
相关题目
6.已知:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ•mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ•mol-1
现有H2与CH4的混合气体112L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3695kJ,则原混合气体中H2与CH4的物质的量之比是( )
CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ•mol-1
现有H2与CH4的混合气体112L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3695kJ,则原混合气体中H2与CH4的物质的量之比是( )
| A. | 1:1 | B. | 2:3 | C. | 1:4 | D. | 1:3 |
7.下列仪器能用于加热操作而且加热时必须垫石棉网的是( )
| A. | 试管 | B. | 烧瓶 | C. | 量筒 | D. | 蒸发皿 |
16.以下物质间的每步转化通过一步反应不能实现的是( )
| A. | Na→Na2O→NaOH→Na2CO3 | B. | Al→Al2O3→Al2(SO4)3→Al(OH)3 | ||
| C. | S→SO3→H2SO4→SO2 | D. | N2→NO→NO2→HNO3 |
6.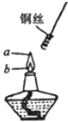 如图,某同学做乙醇氧化实验时,将螺旋状铜丝先放到a点处加热,然后再移到b点,发现铜丝在火焰a、b两点时现象明显不同.请你写出a、b两点的实验现象,并解释产生该现象的原因,并写出化学反应方程式.
如图,某同学做乙醇氧化实验时,将螺旋状铜丝先放到a点处加热,然后再移到b点,发现铜丝在火焰a、b两点时现象明显不同.请你写出a、b两点的实验现象,并解释产生该现象的原因,并写出化学反应方程式.
 如图,某同学做乙醇氧化实验时,将螺旋状铜丝先放到a点处加热,然后再移到b点,发现铜丝在火焰a、b两点时现象明显不同.请你写出a、b两点的实验现象,并解释产生该现象的原因,并写出化学反应方程式.
如图,某同学做乙醇氧化实验时,将螺旋状铜丝先放到a点处加热,然后再移到b点,发现铜丝在火焰a、b两点时现象明显不同.请你写出a、b两点的实验现象,并解释产生该现象的原因,并写出化学反应方程式.| 实验现象 | 解释 | 化学方程式 | |
| a | |||
| b |
13.设NA 表示阿伏加德罗常数,下列说法正确的是( )
| A. | 常温常压下,11.2 L氯气所含有的原子数目为NA | |
| B. | 9 g水所含有的氢原子数目为NA | |
| C. | 在同温同压时,相同物质的量的任何气体的体积相同且为11.2L | |
| D. | 0.1 mol甲烷分子含有的原子数目为NA |
11.某元素X的气态氢化物的化学式HX,则X的最高价氧化物的水化物的化学式为( )
| A. | H2XO3 | B. | HXO4 | C. | H3XO4 | D. | H2XO4 |
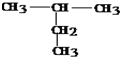 :2-甲基丁烷
:2-甲基丁烷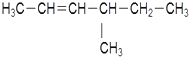 :4-甲基-2-己烯
:4-甲基-2-己烯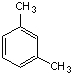 1,3-二甲苯.
1,3-二甲苯.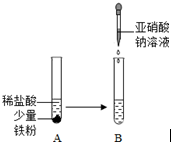 亚硝酸钠(NaNO2)俗称工业盐,外观和食盐相似,有咸味,易溶于水,水溶液显碱性,加强热时能分解产生有刺激性气味的气体,人若误食会引起中毒,致死量为0.3g~0.5g,它使人中毒是因为它能将人体血红蛋白中的Fe2+转化为Fe3+,从而使血红蛋白丧失携氧能力.
亚硝酸钠(NaNO2)俗称工业盐,外观和食盐相似,有咸味,易溶于水,水溶液显碱性,加强热时能分解产生有刺激性气味的气体,人若误食会引起中毒,致死量为0.3g~0.5g,它使人中毒是因为它能将人体血红蛋白中的Fe2+转化为Fe3+,从而使血红蛋白丧失携氧能力.