题目内容
【题目】已知:I2在水中溶解度很小,在KI溶液中溶解度显著增大。 I2在KI溶液中存在下列平衡:I2(aq)+I-(aq) ![]() I3 -(aq)。测得不同温度下该反应的平衡常数如下图所示,下列说法正确的是( )
I3 -(aq)。测得不同温度下该反应的平衡常数如下图所示,下列说法正确的是( )
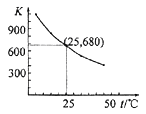
A.反应I2(aq)+I-(aq) ![]() I3 -(aq)的ΔH>0
I3 -(aq)的ΔH>0
B.利用该反应可以除去硫粉中少量的碘单质
C.在上述平衡体系中加入苯,平衡不移动
D.25℃时,在上述平衡体系中加入少量KI固体,平衡常数K小于680
【答案】B
【解析】
试题分析:A.由表中数据可知,温度越大平衡常数越小,说明升高温度平衡向逆反应方向移动,故正反应方向为放热反应,即△H<0,故A错误;B.硫难溶于水,而碘单质与I-形成I3-而溶于水,可以达到除去少量碘的目的,故B正确;C.加入苯,碘能溶于苯,这样水中碘的浓度变小,平衡向逆左移动,故C错误;D.加入KI固体,平衡向右移动,但平衡常数只受温度影响,与物质的浓度无关,加入少量KI固体,平衡常数K不变,故D错误;故选B。

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目

