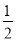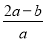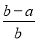题目内容
在相同的温度下,体积均为0.25 L的两恒容密闭容器中发生可逆反应:N2(g)+3H2(g) 2NH3(g) ΔH=-92.6 kJ/mol。实验测得起始、平衡时的有关数据如表所示,下列叙述错误的是( )
2NH3(g) ΔH=-92.6 kJ/mol。实验测得起始、平衡时的有关数据如表所示,下列叙述错误的是( )
| 起始时各物质的物质 的量(mol) | 达到平衡时能量变化 | ||
容器编号 | N2 | H2 | NH3 | |
① | 1 | 3 | 0 | 放出23.15 kJ能量 |
② | 0.9 | 2.7 | 0.2 | 放出Q kJ能量 |
A.容器①、②中反应的化学平衡常数相等
B.平衡时,两容器中氨气的体积分数均为14.3%
C.反应②达到平衡时,放出的热量Q=23.15 kJ
D.若①的体积为0.5 L,则达到平衡时放出的热量小于23.15 kJ
C
【解析】A项,平衡常数只与温度有关,A对;B项,两容器中平衡等效,NH3的体积分数相同,B对;C项,因为两容器的始态不同而终态相同,Q≠23.15 kJ,C错;D项,增大体积,减小压强,平衡左移,放出的热量减少,D对。

 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案单质铜及其化合物一般都具有特殊的颜色,如
Cu | Cu2O | CuO | Cu(OH)2 | CuSO4·5H2O |
红色(或紫红色) | 红色(或砖红色) | 黑色 | 蓝色 | 蓝色 |
某学校学习小组甲为检测实验室用H2还原CuO所得红色固体中是否含有Cu2O,进行了认真的研究。
Ⅰ.查阅资料得出下列信息:
①Cu2O属于碱性氧化物;
②高温灼烧CuO生成Cu2O;
③Cu2O在酸性条件下能发生反应:Cu2O+2H+=Cu+Cu2++H2O。
Ⅱ.设计实验方案:
方案1:取该红色固体溶于足量的稀硝酸中,观察溶液颜色变化。
方案2:取该红色固体溶于足量的稀硫酸中,观察溶液是否呈蓝色。
方案3:称得干燥坩埚的质量为a g,取红色固体置于坩埚中称得总质量为b g,在空气中高温灼烧至质量恒定,称得最后总质量为c g。
(1)写出Cu2O与稀硝酸反应的化学方程式:_______________________。
(2)请你评价方案1和方案2的合理性,并简述理由:
方案1:_______________________。
方案2:_______________________。
(3)方案3中,若确认红色固体中含有Cu2O,则a、b、c的关系为________,在该实验方案中最少应进行________次称量。
Ⅲ.学习小组乙设计了新的探究方案,拟根据干燥管中无水硫酸铜是否变蓝判断红色固体中是否含有Cu2O,装置如图所示。

(4)该探究方案中检验气体发生装置气密性的方法为________(说明操作方法、现象和结论)。
(5)为确保探究的科学、合理和安全,你认为实验中还应采取的措施有____(填序号)。
A.在氢气发生装置与硬质玻璃管之间增加一个干燥装置
B.加热前先排尽装置中的空气
C.在盛有无水硫酸铜的干燥管后再连接一个装有碱石灰的干燥管