题目内容
能源的开发利用与人类社会的可持续发展息息相关。
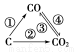
Ⅰ.已知:Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)
ΔH1=a kJ·mol-1
CO(g)+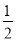 O2(g)=CO2(g) ΔH2=b kJ·mol-1
O2(g)=CO2(g) ΔH2=b kJ·mol-1
4Fe(s)+3O2(g)=2Fe2O3(s) ΔH3=c kJ·mol-1
则C的燃烧热ΔH=________kJ·mol-1。
Ⅱ.(1)依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是________(填序号)。
A.C(s)+CO2(g)=2CO(g)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)
C.2H2O(l)=2H2(g)+O2(g)
D.2CO(g)+O2(g)=2CO2(g)
若以熔融的K2CO3与CO2为反应的环境,依据所选反应设计成一个原电池,请写出该原电池的负极反应:_____________________________________。
(2)某实验小组模拟工业合成氨反应N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,开始他们将N2和H2混合气体20 mol(体积比1∶1)充入5 L合成塔中,反应前压强为P0,反应过程中压强用P表示,反应过程中
2NH3(g) ΔH=-92.4 kJ·mol-1,开始他们将N2和H2混合气体20 mol(体积比1∶1)充入5 L合成塔中,反应前压强为P0,反应过程中压强用P表示,反应过程中 与时间t的关系如图所示。
与时间t的关系如图所示。
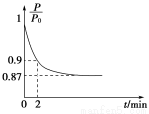
请回答下列问题:
①反应达平衡的标志是__________________________(填字母代号,下同)。
A.压强保持不变
B.气体密度保持不变
C.NH3的生成速率是N2的生成速率的2倍
②0~2 min内,以c(N2)变化表示的平均反应速率为________________。
③欲提高N2的转化率,可采取的措施有_____________________________。
A.向体系中按体积比1∶1再充入N2和H2
B.分离出NH3
C.升高温度
D.充入氦气使压强增大
E.加入一定量的N2
(3)25℃时,BaCO3和BaSO4的溶度积常数分别是8×10-9和1×10-10,某含有BaCO3沉淀的悬浊液中,c(CO32-)=0.2 mol·L-1,如果加入等体积的Na2SO4溶液,若要产生BaSO4沉淀,加入Na2SO4溶液的物质的量浓度最小是________mol·L-1。
Ⅰ. 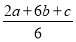
Ⅱ.(1)D CO-2e-+CO32-=2CO2
(2)①AC ②0.1 mol·L-1·min-1 ③AB (3)0.01
【解析】Ⅰ.三个热化学方程式依次编号为①、②、③,根据盖斯定律,(①×2+②×6+③)÷6得,C(s)+O2(g)=CO2(g) ΔH=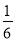 (2a+6b+c)kJ·mol-1,则C的燃烧热为
(2a+6b+c)kJ·mol-1,则C的燃烧热为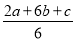 kJ·mol-1。Ⅱ.(1)自发的氧化还原反应可以设计成原电池,选D;负极失电子发生氧化反应,负极反应为CO-2e-+CO32-=2CO2。
kJ·mol-1。Ⅱ.(1)自发的氧化还原反应可以设计成原电池,选D;负极失电子发生氧化反应,负极反应为CO-2e-+CO32-=2CO2。
(2)①此反应是反应前后气体分子数不相等的反应,压强不变说明达到平衡;因为气体总的质量不变,容器体积不变,所以密度始终不变,不能运用密度不变作为反应达到平衡的标志,NH3的生成速率是N2的生成速率的2倍,说明反应达到平衡。②设反应的N2为x mol,则反应的H2为3x mol,生成的NH3为2x mol,由压强关系得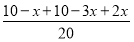 =0.9,解得x=1,则用氮气表示的平均反应速率为
=0.9,解得x=1,则用氮气表示的平均反应速率为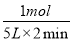 =0.1 mol·L-1·min-1。③此反应的正反应为放热反应,所以升高温度平衡逆向移动,氮气的转化率降低,C错误;充入氦气使压强增大,但各物质的浓度不变,平衡不移动,氮气的转化率不变,D错误;加入一定量的氮气,氮气的转化率降低,E错误。(3)根据题给数据,由Ksp(BaCO3)=c(Ba2+)·c(CO32-)得c(Ba2+)=4×10-8mol·L-1,混合后溶液中,c(Ba2+)=2×10-8mol·L-1,要想产生BaSO4沉淀,至少需要
=0.1 mol·L-1·min-1。③此反应的正反应为放热反应,所以升高温度平衡逆向移动,氮气的转化率降低,C错误;充入氦气使压强增大,但各物质的浓度不变,平衡不移动,氮气的转化率不变,D错误;加入一定量的氮气,氮气的转化率降低,E错误。(3)根据题给数据,由Ksp(BaCO3)=c(Ba2+)·c(CO32-)得c(Ba2+)=4×10-8mol·L-1,混合后溶液中,c(Ba2+)=2×10-8mol·L-1,要想产生BaSO4沉淀,至少需要
c(Ba2+)·c(SO42-)=Ksp(BaSO4),计算得c(SO42-)=5×10-3mol·L-1,则加入Na2SO4溶液的物质的量浓度最小是0.01 mol·L-1。

 活力课时同步练习册系列答案
活力课时同步练习册系列答案在相同的温度下,体积均为0.25 L的两恒容密闭容器中发生可逆反应:N2(g)+3H2(g) 2NH3(g) ΔH=-92.6 kJ/mol。实验测得起始、平衡时的有关数据如表所示,下列叙述错误的是( )
2NH3(g) ΔH=-92.6 kJ/mol。实验测得起始、平衡时的有关数据如表所示,下列叙述错误的是( )
| 起始时各物质的物质 的量(mol) | 达到平衡时能量变化 | ||
容器编号 | N2 | H2 | NH3 | |
① | 1 | 3 | 0 | 放出23.15 kJ能量 |
② | 0.9 | 2.7 | 0.2 | 放出Q kJ能量 |
A.容器①、②中反应的化学平衡常数相等
B.平衡时,两容器中氨气的体积分数均为14.3%
C.反应②达到平衡时,放出的热量Q=23.15 kJ
D.若①的体积为0.5 L,则达到平衡时放出的热量小于23.15 kJ