题目内容
(8分)①密度为1.095 g/mL、质量分数为20%的盐酸的物质的量浓度是多少?。②取此盐酸50 mL和足量的锌反应,写出该反应的离子方程式,并计算放出的H2在标准状况下的体积。
(8分)(1)①6(3分)②Zn+2H+=Zn2++H2↑(2分) 3.36L(3分)
试题分析:①根据
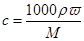 可知,密度为1.095 g/mL、质量分数为20%的盐酸的物质的量浓度是
可知,密度为1.095 g/mL、质量分数为20%的盐酸的物质的量浓度是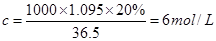 。
。②50ml6mol/L的盐酸中溶质的物质的量是0.05L×6mol/L=0.3mol。反应的离子方程式是Zn+2H+=Zn2++H2↑,所以根据反应的方程式可知,生成氢气的物质的量是0.3mol÷2=0.15mol。因此在标准状况下的体积是0.15mol×22.4L/mol=3.36L。
点评:在进行物质的量的有关计算时,关键是熟练应用几个关系式
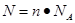 、n=m/M、
、n=m/M、 、
、 ,特别还要注意气体摩尔体积的使用条件,即只能适用于气体,且只有在标准状况下,气体的摩尔体积才是22.4L/mol。另外如果是根据反应的方程式进行计算,还必须写出应该的方程式,找出已知量和未知量之间的关系,如果列式计算即可。
,特别还要注意气体摩尔体积的使用条件,即只能适用于气体,且只有在标准状况下,气体的摩尔体积才是22.4L/mol。另外如果是根据反应的方程式进行计算,还必须写出应该的方程式,找出已知量和未知量之间的关系,如果列式计算即可。
练习册系列答案
相关题目