题目内容
【题目】1500C、1.0×105Pa时,aL乙炔,aL甲烷和aL丙烯的混合气体与过量的bLO2混合,点燃使这两种烃充分燃烧后,再恢复到原状况,此时混合气体的体积为
A. 10aL B. (3a+b)L C. (b-a)L D. 无法计算
【答案】B
【解析】
先写出三种物质燃烧反应的化学方程式,在150℃时水是气体,观察物质燃烧前后的气体体积变化,再分析气体混合物的总体积。
氧气过量时,燃烧发生反应:2C2H2+5O2![]() 4CO2+2H2O、CH4+2O2
4CO2+2H2O、CH4+2O2![]() CO2+2H2O 、2C3H6+9O2
CO2+2H2O 、2C3H6+9O2 ![]() 6CO2+6H2O,恢复150℃、1.01×105Pa时,生成的水为气态,由方程式可知,2体积乙炔燃烧后气体体积减少1体积,甲烷燃烧前后气体的体积不变,而2体积丙烯燃烧后气体体积增大1体积,故燃烧后混合物气体的体积不变,此时混合气体的体积为(a+a+a+b)L=(3a+b)L,选项B符合题意。
6CO2+6H2O,恢复150℃、1.01×105Pa时,生成的水为气态,由方程式可知,2体积乙炔燃烧后气体体积减少1体积,甲烷燃烧前后气体的体积不变,而2体积丙烯燃烧后气体体积增大1体积,故燃烧后混合物气体的体积不变,此时混合气体的体积为(a+a+a+b)L=(3a+b)L,选项B符合题意。

【题目】(2018·安徽省合肥市高三第三次教学质量检测)H2S在重金属离子处理、煤化工等领域都有重要应用。请回答:
Ⅰ.H2S是煤化工原料气脱硫过程的重要中间体,反应原理为
ⅰ.COS(g)+H2(g)![]() H2S(g)+CO(g)△H=+7kJ·mol1
H2S(g)+CO(g)△H=+7kJ·mol1
ⅱ.CO(g)+H2O(g)![]() CO2(g)+H2(g)△H=42kJ·mol1
CO2(g)+H2(g)△H=42kJ·mol1
已知断裂1mol气态分子中的化学键所需能量如下表所示。
分子 | COS(g) | H2(g) | CO(g) | H2S(g) |
能量(kJ·mol1) | 1310 | 442 | x | 669 |
(1)计算表中x=_______。
(2)T℃时,向VL容积不变的密闭容器中充入1mol COS(g)、1mol H2(g)和1mol H2O(g),发生上述两个反应。
①在T℃时测得平衡体系中COS为0.80 mol,H2为0.85 mol,则T℃时反应ⅰ的平衡常数K=_______(保留2位有效数字)。
②上述反应达平衡后,若向其中再充入1mol COS(g)、1molH2(g)和1mol H2O(g),则再次达平衡后H2的体积分数_______(填“增大”、“减小”或“不变”);若升高温度,则CO的平衡体积分数_______(填“增大”、“减小”或“不变”),其理由是_______。
Ⅱ.H2S在高温下分解制取H2,同时生成硫蒸气。
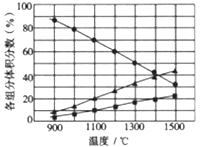
(3)向2L密闭容器中加入0.2molH2S,反应在不同温度(900~1500℃)下达到平衡时,混合气体中各组分的体积分数如下图所示,则在此温度区间内,H2S分解反应的主要化学方程式为_______;在1300℃时,反应经2min达到平衡,则0~2min的反应速率v(H2S)=_______。
Ⅲ.H2S用作重金属离子的沉淀剂。
(4)25℃时,向浓度均为0.001mol·L1Sn2+和Ag+的混合溶液中通入H2S,当Sn2+开始沉淀时,溶液中c(Ag+)=_______。(已知:25℃时,Ksp(SnS)=1.0×1025,Ksp(Ag2S)=1.6×1049)。
【题目】氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为
N2(g)+3H2(g)![]() 2NH3(g) △H。
2NH3(g) △H。
(1)已知每破坏1mol有关化学键需要的能量如下表:
H-H | N-H | N-N | N |
435.9KJ | 390.8KJ | 192.8KJ | 945.8KJ |
则△H=_____________。
(2)在恒温、恒压容器中,氨体积比1:3加入N2和H2进行合成氨反应,达到平衡后,再向容器中充入适量氨气,达到新平衡时,c(H2)将_________(填“增大”“减小”或“不变”)
(3)在不同温度、压强和相同催化剂条件下,初始时N2、H2分别为0.1mol、0.3mol时,平衡后混合物中氨的体积分数(φ)如图所示。

①其中,p1、p2和p3由大到小的顺序是________,其原因是__________。
②若分别用vA(N2)和vB(N2)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(N2)______ vB(N2)(填“>”“<”或“=”)
③若在250℃、p1条件下,反应达到平衡时容器的体积为1L,则该条件下合成氨的平衡常数K=___(保留一位小数)。
(4)H2NCOONH4是工业由氨气合成尿素的中间产物。在一定温度下、体积不变的密闭容器中发生反应:H2NCOONH4(s) ![]() 2NH3(g)+CO2(g),能说明该反应达到平衡状态的是_____(填序号)。
2NH3(g)+CO2(g),能说明该反应达到平衡状态的是_____(填序号)。
①混合气体的压强不变
②混合气体的密度不变
③混合气体的总物质的量不变
④混合气体的平均相对分子质量不变
⑤NH3的体积分数不变



