题目内容
【题目】目前世界上60%的镁单质是从海水中提取的,已知海水提镁的主要步骤如图:
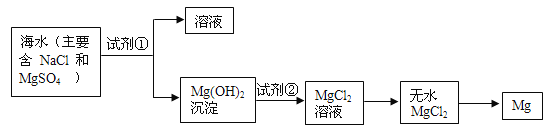
(1)为了使MgSO4转化为Mg(OH)2,试剂①可选用_______。试剂②可选用_______。
(2)本生产流程主要牵涉三个化学反应:写出前两个式子
A.海水→沉淀:__________________(离子方程式)
B.沉淀→溶液:__________________(离子方程式)
C.MgCl2→Mg:
(3)海水中提镁中如何实现对镁离子的富集_______(填代号).
A.直接往海水中加入沉淀剂
B.高温加热蒸发海水后,再加入沉淀剂
C.利用晒盐后的苦卤水,再加入沉淀剂
【答案】石灰乳盐酸Ca(OH)2+Mg2+=Mg(OH)2+Ca2+Mg(OH)2+2H+=Mg2++2H2OC
【解析】(1)使MgSO4转化为Mg(OH)2,应选择碱,在转化中不引入新的离子,则试剂①选择石灰乳;
(2)A.海水沉淀是镁离子结合氢氧根离子生成氢氧化镁沉淀,反应的离子方程式为:Ca(OH)2+Mg2+=Mg(OH)2+Ca2+ ;
B.氢氧化镁溶于盐酸生成氯化镁溶液,反应的离子方程式为:Mg(OH)2+2H+=Mg2++2H2O;
(3)海水晒盐后的母液浓缩蒸发,加入沉淀剂氢氧化钙沉淀镁离子,可以起到富集镁离子的作用,故答案为C。

练习册系列答案
相关题目