题目内容
2.下列四样溶液中,c(H+)浓度最大的是( )| A. | 50mL 1.0mol/L的HCl | B. | 10mL 2.0mol/L 的NaCl | ||
| C. | 20mL 1.5mol/L 的HNO3 | D. | 10mL 1.0mol/L的H2SO4 |
分析 HCl、HNO3、H2SO4溶液都呈酸性,NaCl为中性溶液,结合物质的构成判断c(H+)大小.
解答 解:A.50mL 1.0mol/L的HClc(H+)=1.0mol/L;
B.10mL 2.0mol/L 的NaCl溶液呈中性;
C.20mL 1.5mol/L 的HNO3c(H+)=1.5mol/L;
D.10mL 1.0mol/L的H2SO4c(H+)=2.0mol/L.
则浓度最大的为D.
故选D.
点评 本题考查物质的量浓度的计算,侧重于学生的分析、计算能力的考查,注意把握物质的构成,难度不大.

练习册系列答案
相关题目
12.下列有机物中,不溶于水的是( )
| A. | 酒精 | B. | 醋酸 | C. | 乙醚 | D. | 乙酸乙酯 |
13.下列说法正确的是( )
| A. | pH=6的溶液一定是酸性溶液 | |
| B. | 在等温等压条件下,能自发进行的化学反应,不一定是△H<0、△S>0 | |
| C. | 吸热反应一定需要加热才能发生,放热反应都能自发进行 | |
| D. | 弱电解质的电离常数既与弱电解质的性质和温度有关,也与溶液中的离子浓度有关 |
10.下列说法正确的是( )
| A. | 选择萃取剂将碘从碘水中萃取出来,这种萃取剂应具备的性质是不溶于水,且比水的密度大 | |
| B. | 选择萃取剂将碘从碘水中萃取出来,这种萃取剂应具备的性质是不溶于水,且比水的密度小 | |
| C. | 在使用分液漏斗进行分液时,上层液体经漏斗下口放出 | |
| D. | 选择萃取剂将碘从碘水中萃取出来,碘在四氯化碳中的溶解度比在水中的溶解度大 |
17.下列说法正确的是(NA表示阿伏加德罗常数)( )
| A. | 15g 甲基中含有的电子数为10NA | |
| B. | 标准状况下,以任意比例混合的甲烷和丙烷混合物22.4L,所含有的分子数为NA | |
| C. | 标准状况下的22.4L辛烷完全燃烧,生成二氧化碳分子数为8NA | |
| D. | 在1L 1mol/L 的盐酸溶液中,所含氯化氢分子数为NA |
14.图表归纳是学习化学的一种常用方法.下列某同学归纳的表与图中对应关系正确的是( )
| 选项 | X | Y | Z | 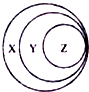 |
| A | 胶体 | 分散系 | 淀粉溶液 | |
| B | 强电解质 | 强酸 | 硫酸 | |
| C | 化合物 | 酸性氧化物 | 非金属氧化物 | |
| D | 离子反应 | 复分解反应 | 酸与盐的反应 |
| A. | A | B. | B | C. | C | D. | D |
12.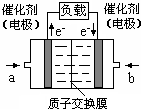 可给笔记本电脑供电的甲醇燃料电池已经面世,其结构示意图如下.甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一电极后与氧气反应,电池总反应为:2CH3OH+3O2=2CO2+4H2O.下列说法不正确的是( )
可给笔记本电脑供电的甲醇燃料电池已经面世,其结构示意图如下.甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一电极后与氧气反应,电池总反应为:2CH3OH+3O2=2CO2+4H2O.下列说法不正确的是( )
 可给笔记本电脑供电的甲醇燃料电池已经面世,其结构示意图如下.甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一电极后与氧气反应,电池总反应为:2CH3OH+3O2=2CO2+4H2O.下列说法不正确的是( )
可给笔记本电脑供电的甲醇燃料电池已经面世,其结构示意图如下.甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一电极后与氧气反应,电池总反应为:2CH3OH+3O2=2CO2+4H2O.下列说法不正确的是( )| A. | 右电极为电池正极,b处通入的物质是空气 | |
| B. | 左电极为电池负极,a处通入的物质是空气 | |
| C. | 负极反应式为:CH3OH+H2O-6e-=CO2+6H+ | |
| D. | 正极反应式为:O2+4H++4e-=2H2O |