��Ŀ����
��2012?ʯ��ׯ��ģ��ij��ѧС��Ϊ�ⶨ�ӵ�����KIO3�������������Ʊ�����KIO3������������ʵ�飮
I���ⶨ�ӵ�����KIO3���������������ʲ�������Ӧ��
��֪��KIO3+3H2SO4+5KI=3I2+3K2CO3+3H2O�� I2+2Na2S2O3=2Na I+Na 2S4O6
����һ��ȷ��ȡa g�ӵ��Σ����Ƴ�250mL��Һ��
�������ȡ������Һ25.00mL����ƿ�У���ϡ�����ữ���ټ�������KI��Һ��
���������Ե���Ϊָʾ������c mol?L-1��Na2S2O3��Һ�ζ������������Һ���յ㣬��¼���ݣ��ظ��ζ�2�Σ�ƽ������Na2S2O3��Һ12.00mL��
��1������һ������250mL��Һ�õ��IJ����������ձ�������������Ͳ�⣬����
��2���������е���ζ��յ�ʱ������Ϊ
��3��ʵ���ô˼ӵ�����KIO3����������=
%
%��KIO3����Է�������Ϊ214����
II��ʵ�����Ʊ�KIO3
��֪�������ο����������ڼ�����Һ�������⻯��õ���
�û�ѧС��ͨ������װ���Ʊ�KIO3��
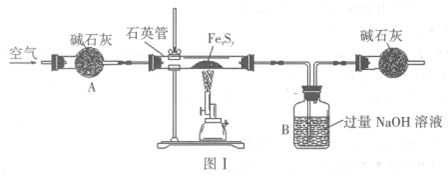
��4��װ��A�з�Ӧ�����ӷ���ʽΪ
��5��װ��B�е��Լ�Ϊ
��6��д��װ��C������KIO3�����ӷ���ʽ
��7������ʵ��װ�ô���һ������ȱ�ݣ���ָ��
I���ⶨ�ӵ�����KIO3���������������ʲ�������Ӧ��
��֪��KIO3+3H2SO4+5KI=3I2+3K2CO3+3H2O�� I2+2Na2S2O3=2Na I+Na 2S4O6
����һ��ȷ��ȡa g�ӵ��Σ����Ƴ�250mL��Һ��
�������ȡ������Һ25.00mL����ƿ�У���ϡ�����ữ���ټ�������KI��Һ��
���������Ե���Ϊָʾ������c mol?L-1��Na2S2O3��Һ�ζ������������Һ���յ㣬��¼���ݣ��ظ��ζ�2�Σ�ƽ������Na2S2O3��Һ12.00mL��
��1������һ������250mL��Һ�õ��IJ����������ձ�������������Ͳ�⣬����
250mL����ƿ
250mL����ƿ
����2���������е���ζ��յ�ʱ������Ϊ
��Һ��ɫ��ɫ
��Һ��ɫ��ɫ
����3��ʵ���ô˼ӵ�����KIO3����������=
| 428c |
| a |
| 428c |
| a |
II��ʵ�����Ʊ�KIO3
��֪�������ο����������ڼ�����Һ�������⻯��õ���
�û�ѧС��ͨ������װ���Ʊ�KIO3��

��4��װ��A�з�Ӧ�����ӷ���ʽΪ
MnO2+4H++2Cl-
Mn2++Cl2��+2H2O
| ||
MnO2+4H++2Cl-
Mn2++Cl2��+2H2O
��
| ||
��5��װ��B�е��Լ�Ϊ
����ʳ��ˮ
����ʳ��ˮ
����6��д��װ��C������KIO3�����ӷ���ʽ
3Cl2+I-+6OH-=6Cl-+IO3-+3H2O
3Cl2+I-+6OH-=6Cl-+IO3-+3H2O
����7������ʵ��װ�ô���һ������ȱ�ݣ���ָ��
ȱ������������β������װ��
ȱ������������β������װ��
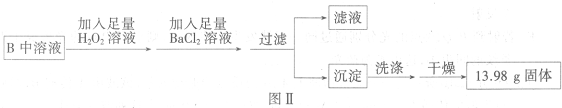
����������1������250mL��Һ�õ���������������ƽ��ҩ�ס����������ձ���250mL����ƿ����Ͳ�����ÿɲ��ã����ݴ��жϣ�
��2�������������I2��������ۣ���Һ����ɫ����Na2S2O3��Һ�ζ���I2��Ӧ��ϣ���Һ��ɫ��ɫ��
��3�����ݹ�ϵʽKIO3��3I2��6Na2S2O3���㣻
��4������Ŀ��Ϣ��֪�������ڼ�����Һ�������⻯��õ������Σ���װ��ͼ��֪��װ��AΪ�Ʊ������������Ʊ�������ʵ����ͨ���ö���������Ũ������ȷ�Ӧ�����Ȼ��̡�������ˮ�Ʊ���
��5��Ũ������лӷ��ԣ��Ʊ��������к���HCl��Ӱ��Cװ���еķ�Ӧ��װ��B����HCl�����ȥ��ͨ���ñ���ʳ��ˮ����HCl�������������ܽ⣻
��6������Ŀ��Ϣ��֪�������ڼ�����Һ�������⻯��õ������Σ���װ��C�з�����ӦΪ�����ڼ�������������I-�����������ӡ��������ˮ��
��7�����������ж���ֱ���ŷŵ������У�����Ⱦ������Ӧ��C֮������β������װ�ã�������������ֹ��Ⱦ������
��2�������������I2��������ۣ���Һ����ɫ����Na2S2O3��Һ�ζ���I2��Ӧ��ϣ���Һ��ɫ��ɫ��
��3�����ݹ�ϵʽKIO3��3I2��6Na2S2O3���㣻
��4������Ŀ��Ϣ��֪�������ڼ�����Һ�������⻯��õ������Σ���װ��ͼ��֪��װ��AΪ�Ʊ������������Ʊ�������ʵ����ͨ���ö���������Ũ������ȷ�Ӧ�����Ȼ��̡�������ˮ�Ʊ���
��5��Ũ������лӷ��ԣ��Ʊ��������к���HCl��Ӱ��Cװ���еķ�Ӧ��װ��B����HCl�����ȥ��ͨ���ñ���ʳ��ˮ����HCl�������������ܽ⣻
��6������Ŀ��Ϣ��֪�������ڼ�����Һ�������⻯��õ������Σ���װ��C�з�����ӦΪ�����ڼ�������������I-�����������ӡ��������ˮ��
��7�����������ж���ֱ���ŷŵ������У�����Ⱦ������Ӧ��C֮������β������װ�ã�������������ֹ��Ⱦ������
����⣺��1������250mL��Һ�õ���������������ƽ��ҩ�ס����������ձ���250mL����ƿ����Ͳ�����ÿɲ��ã����ʻ���Ҫ�IJ��������У�250mL����ƿ��
�ʴ�Ϊ��250mL����ƿ��
��2�������������I2��������ۣ���Һ����ɫ����Na2S2O3��Һ�ζ���I2��Ӧ��ϣ���Һ��ɫ��ɫ���ʴ�Ϊ����Һ��ɫ��ɫ��
��3��25mL��Һ����Na2S2O3�����ʵ���Ϊc mol?L-1��0.012L=0.012mol����250mL��ҺӦ����Na2S2O3�����ʵ���Ϊ0.012cmol��10=0.12cmol����250mL��Һ��KIO3�����ʵ���Ϊxmol����
KIO3��������3I2��������6Na2S2O3
1 6
xmol 0.12cmol
����x=0.02c
�ʼӵ�����KIO3����������
��100%=
%��
�ʴ�Ϊ��
%��
��4������Ŀ��Ϣ��֪�������ڼ�����Һ�������⻯��õ������Σ���װ��ͼ��֪��װ��AΪ�Ʊ������������Ʊ�������ʵ����ͨ���ö���������Ũ������ȷ�Ӧ�����Ȼ��̡�������ˮ�Ʊ���װ��A�ķ�Ӧ���ӷ���ʽΪMnO2+4H++2Cl-
Mn2++Cl2��+2H2O��
�ʴ�Ϊ��MnO2+4H++2Cl-
Mn2++Cl2��+2H2O��
��5��Ũ������лӷ��ԣ��Ʊ��������к���HCl��Ӱ��Cװ���еķ�Ӧ��װ��B����HCl�����ȥ��ͨ���ñ���ʳ��ˮ����HCl�������������ܽ⣬
�ʴ�Ϊ������ʳ��ˮ��
��6������Ŀ��Ϣ��֪�������ڼ�����Һ�������⻯��õ������Σ���װ��C�з�����ӦΪ�����ڼ�������������I-�����������ӡ��������ˮ����Ӧ���ӷ���ʽΪ3Cl2+I-+6OH-=6Cl-+IO3-+3H2O���ʴ�Ϊ��3Cl2+I-+6OH-=6Cl-+IO3-+3H2O��
��7�����������ж���ֱ���ŷŵ������У�����Ⱦ������Ӧ��C֮������β������װ�ã�������������ֹ��Ⱦ�������ʴ�Ϊ��ȱ������������β������װ�ã�
�ʴ�Ϊ��250mL����ƿ��
��2�������������I2��������ۣ���Һ����ɫ����Na2S2O3��Һ�ζ���I2��Ӧ��ϣ���Һ��ɫ��ɫ���ʴ�Ϊ����Һ��ɫ��ɫ��
��3��25mL��Һ����Na2S2O3�����ʵ���Ϊc mol?L-1��0.012L=0.012mol����250mL��ҺӦ����Na2S2O3�����ʵ���Ϊ0.012cmol��10=0.12cmol����250mL��Һ��KIO3�����ʵ���Ϊxmol����
KIO3��������3I2��������6Na2S2O3
1 6
xmol 0.12cmol
����x=0.02c
�ʼӵ�����KIO3����������
| 0.02cmol��214g/mol |
| ag |
| 428c |
| a |
�ʴ�Ϊ��
| 428c |
| a |
��4������Ŀ��Ϣ��֪�������ڼ�����Һ�������⻯��õ������Σ���װ��ͼ��֪��װ��AΪ�Ʊ������������Ʊ�������ʵ����ͨ���ö���������Ũ������ȷ�Ӧ�����Ȼ��̡�������ˮ�Ʊ���װ��A�ķ�Ӧ���ӷ���ʽΪMnO2+4H++2Cl-
| ||
�ʴ�Ϊ��MnO2+4H++2Cl-
| ||
��5��Ũ������лӷ��ԣ��Ʊ��������к���HCl��Ӱ��Cװ���еķ�Ӧ��װ��B����HCl�����ȥ��ͨ���ñ���ʳ��ˮ����HCl�������������ܽ⣬
�ʴ�Ϊ������ʳ��ˮ��
��6������Ŀ��Ϣ��֪�������ڼ�����Һ�������⻯��õ������Σ���װ��C�з�����ӦΪ�����ڼ�������������I-�����������ӡ��������ˮ����Ӧ���ӷ���ʽΪ3Cl2+I-+6OH-=6Cl-+IO3-+3H2O���ʴ�Ϊ��3Cl2+I-+6OH-=6Cl-+IO3-+3H2O��
��7�����������ж���ֱ���ŷŵ������У�����Ⱦ������Ӧ��C֮������β������װ�ã�������������ֹ��Ⱦ�������ʴ�Ϊ��ȱ������������β������װ�ã�
���������⿼��������ԭ�ζ���Ӧ�á���ʵ��ԭ��������ʵ��װ�õ����ۡ��Ķ���ȡ��Ϣ���������Ѷ��еȣ��Ƕ�֪ʶ���ۺ����������������������Ŀ��飬ע�����֪ʶ�����գ�

��ϰ��ϵ�д�
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
�����Ŀ