题目内容
(2012?石家庄一模)某化学小组为测定某种铁的硫化物FexSy的组成,按照如下步骤进行了实验.
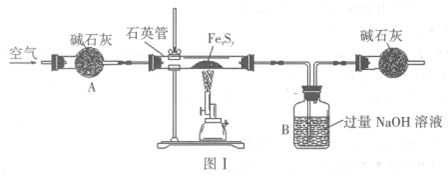
步骤一:利用图Ⅰ所示装置,高温灼烧4.16g FexSy至固体质量不再变化,得到红棕色固体和一种能使品红溶液褪色的气体.
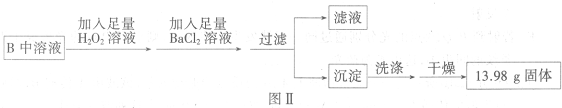
步骤二:将B中所得溶液按图Ⅱ进行处理.
请回答:
(1)步骤一中,当FexSy固体完全反应后,还需继续通入空气片刻,其目的为
(2)加入H2O2溶液的作用为
(3)过滤时用到的玻璃仪器除烧杯外,还有
(4)判断步骤二中沉淀是否已经洗涤干净的操作方法为
(5)利用题中提供的数据可计算得出该铁的硫化物的化学式为
(6)实验过程中若无装置A,则所测FexSy中x:y的值将
(7)某同学认为不用进行步骤二,只需通过测定步骤一中装置B中的溶液在反应前后的质量差,即可确定x:y的值.实验证明按此方法测定的结果偏小,其原因为

步骤一:利用图Ⅰ所示装置,高温灼烧4.16g FexSy至固体质量不再变化,得到红棕色固体和一种能使品红溶液褪色的气体.
步骤二:将B中所得溶液按图Ⅱ进行处理.

请回答:
(1)步骤一中,当FexSy固体完全反应后,还需继续通入空气片刻,其目的为
把生成的SO2气体全部吹入B中被NaOH溶液完全吸收;防止B中液体倒吸入硬质玻璃管中;
把生成的SO2气体全部吹入B中被NaOH溶液完全吸收;防止B中液体倒吸入硬质玻璃管中;
(2)加入H2O2溶液的作用为
SO32-+H2O2═SO42-+H2O
SO32-+H2O2═SO42-+H2O
(用离子方程式表示).(3)过滤时用到的玻璃仪器除烧杯外,还有
漏斗、玻璃棒
漏斗、玻璃棒
(填仪器名称).(4)判断步骤二中沉淀是否已经洗涤干净的操作方法为
取最后一次洗涤所得的溶液少许于试管中,滴加稀硫酸(硫酸钠或硝酸酸化的硝酸银溶液),若无白色沉淀生成,说明沉淀已洗涤干净;若有白色沉淀生成,说明沉淀未洗涤干净
取最后一次洗涤所得的溶液少许于试管中,滴加稀硫酸(硫酸钠或硝酸酸化的硝酸银溶液),若无白色沉淀生成,说明沉淀已洗涤干净;若有白色沉淀生成,说明沉淀未洗涤干净
.(5)利用题中提供的数据可计算得出该铁的硫化物的化学式为
Fe2S3
Fe2S3
.(6)实验过程中若无装置A,则所测FexSy中x:y的值将
偏小
偏小
(填“偏大”、“偏小”或“无影响”).(7)某同学认为不用进行步骤二,只需通过测定步骤一中装置B中的溶液在反应前后的质量差,即可确定x:y的值.实验证明按此方法测定的结果偏小,其原因为
过量的氧气进入装置B中与SO32-反应生成SO42-,造成B中溶液在反应前后的质量差增大
过量的氧气进入装置B中与SO32-反应生成SO42-,造成B中溶液在反应前后的质量差增大
.分析:(1)固体完全反应后,还需继续通入空气片刻,把装置中的SO2全部排到NaOH溶液中被完全吸收;停止加热硬质玻璃管冷却,试管内压强减小会使B中液体倒吸;
(2)H2O2有氧化性能把SO32-转化为SO42-;
(3)根据过滤时的操作分析;
(4)通过检验洗涤液中是否含有钡离子来判断是否洗涤干净;
(5)最后得到的13.98g固体是硫酸钡,根据S原子守恒,求出S元素的质量,再FexSy固体的质量求出Fe元素的质量,然后求出FexSy中的原子个数比;
(6)实验过程中若无装置A,空气中的二氧化碳和二氧化硫会被B装置吸收;
(7)氧气在溶液中能氧化亚硫酸根,所以过量的氧气进入装置B中与SO32-反应生成SO42-,造成B中溶液在反应前后的质量差增大.
(2)H2O2有氧化性能把SO32-转化为SO42-;
(3)根据过滤时的操作分析;
(4)通过检验洗涤液中是否含有钡离子来判断是否洗涤干净;
(5)最后得到的13.98g固体是硫酸钡,根据S原子守恒,求出S元素的质量,再FexSy固体的质量求出Fe元素的质量,然后求出FexSy中的原子个数比;
(6)实验过程中若无装置A,空气中的二氧化碳和二氧化硫会被B装置吸收;
(7)氧气在溶液中能氧化亚硫酸根,所以过量的氧气进入装置B中与SO32-反应生成SO42-,造成B中溶液在反应前后的质量差增大.
解答:解:(1)固体完全反应后,还需继续通入空气片刻,把装置中的SO2全部排到NaOH溶液中被完全吸收;停止加热硬质玻璃管冷却,试管内压强减小会使B中液体倒吸;
故答案为:把生成的SO2气体全部吹入B中被NaOH溶液完全吸收;防止B中液体倒吸入硬质玻璃管中;
(2)H2O2有氧化性能把SO32-转化为SO42-;其反应的离子方程式为:SO32-+H2O2═SO42-+H2O,
故答案为:SO32-+H2O2═SO42-+H2O;
(3)过滤时要有漏斗,进行过滤,玻璃杯引流,烧杯盛放滤液,所以需要的玻璃仪器有烧杯、漏斗、玻璃棒,
故答案为:漏斗、玻璃棒;
(4)通过检验洗涤液中是否含有钡离子来判断是否洗涤干净,其操作为:取最后一次洗涤所得的溶液少许于试管中,滴加稀硫酸(硫酸钠或硝酸酸化的硝酸银溶液),若无白色沉淀生成,说明沉淀已洗涤干净;若有白色沉淀生成,说明沉淀未洗涤干净,
故答案为:取最后一次洗涤所得的溶液少许于试管中,滴加稀硫酸(硫酸钠或硝酸酸化的硝酸银溶液),若无白色沉淀生成,说明沉淀已洗涤干净;若有白色沉淀生成,说明沉淀未洗涤干净;
(5)最后得到的13.98g固体是硫酸钡,n(BaSO4)=
=0.06mol,根据S原子守恒,则n(S)=0.06mol,
所以FexSy固体的质量Fe元素的质量为4.16g-32g/mol×0.06mol=2.24g,则n(Fe)=
=0.04mol,FexSy中x:y=0.04:0.06=2:3,即硫化物的化学式为Fe2S3;
故答案为:Fe2S3;
(6)实验过程中若无装置A,空气中的二氧化碳和二氧化硫会被B装置吸收;导致最后得到的硫酸钡质量偏大,即硫元素质量偏大,所以所测FexSy中x:y的值将偏小,
故答案为:偏小;
(7)氧气在溶液中能氧化亚硫酸根,所以过量的氧气进入装置B中与SO32-反应生成SO42-,造成B中溶液在反应前后的质量差增大,
故答案为:过量的氧气进入装置B中与SO32-反应生成SO42-,造成B中溶液在反应前后的质量差增大.
故答案为:把生成的SO2气体全部吹入B中被NaOH溶液完全吸收;防止B中液体倒吸入硬质玻璃管中;
(2)H2O2有氧化性能把SO32-转化为SO42-;其反应的离子方程式为:SO32-+H2O2═SO42-+H2O,
故答案为:SO32-+H2O2═SO42-+H2O;
(3)过滤时要有漏斗,进行过滤,玻璃杯引流,烧杯盛放滤液,所以需要的玻璃仪器有烧杯、漏斗、玻璃棒,
故答案为:漏斗、玻璃棒;
(4)通过检验洗涤液中是否含有钡离子来判断是否洗涤干净,其操作为:取最后一次洗涤所得的溶液少许于试管中,滴加稀硫酸(硫酸钠或硝酸酸化的硝酸银溶液),若无白色沉淀生成,说明沉淀已洗涤干净;若有白色沉淀生成,说明沉淀未洗涤干净,
故答案为:取最后一次洗涤所得的溶液少许于试管中,滴加稀硫酸(硫酸钠或硝酸酸化的硝酸银溶液),若无白色沉淀生成,说明沉淀已洗涤干净;若有白色沉淀生成,说明沉淀未洗涤干净;
(5)最后得到的13.98g固体是硫酸钡,n(BaSO4)=
| 13.98g |
| 233g/mol |
所以FexSy固体的质量Fe元素的质量为4.16g-32g/mol×0.06mol=2.24g,则n(Fe)=
| 2.24g |
| 56g/mol |
故答案为:Fe2S3;
(6)实验过程中若无装置A,空气中的二氧化碳和二氧化硫会被B装置吸收;导致最后得到的硫酸钡质量偏大,即硫元素质量偏大,所以所测FexSy中x:y的值将偏小,
故答案为:偏小;
(7)氧气在溶液中能氧化亚硫酸根,所以过量的氧气进入装置B中与SO32-反应生成SO42-,造成B中溶液在反应前后的质量差增大,
故答案为:过量的氧气进入装置B中与SO32-反应生成SO42-,造成B中溶液在反应前后的质量差增大.
点评:本题考查考查物质化学式的测定,以及分离和洗涤操作等知识,侧重于考查学生综合运用化学知识的能力,为高考常见题型,难度中等.

练习册系列答案
 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目
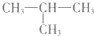 (2012?石家庄一模)2-甲基丙烷(如图)的二氯代物共有(不考虑立体异构)( )
(2012?石家庄一模)2-甲基丙烷(如图)的二氯代物共有(不考虑立体异构)( )