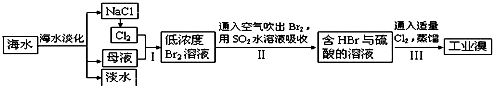
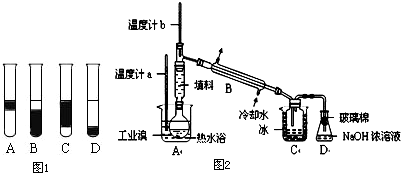
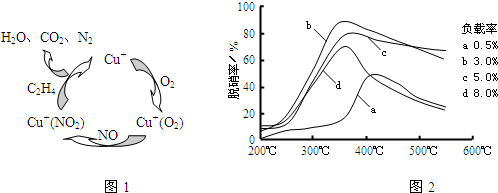
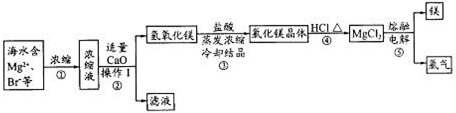
题目内容
材料化学是化学科学研究的热点,某新型无机非金属材料K是由两种非金属元素构成的,它是一种超硬物质,具有耐磨、耐腐蚀、抗氧化的特点,由中学化学中常见物质为原料生产的,下图为其生产过程,其中虚框内是为探究C的组成而设。G、F、H均难溶于水且为白色粉末,图中除M、K(均含A元素)外均为中学化学常见物质。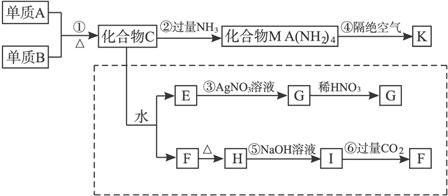
请回答下列问题:
(1)写出化学式:单质B:__________,化合物F:__________。
(2)物质H是__________晶体。
(3)写出下列反应的离子方程式:
反应③______________________________,
反应⑤______________________________,
反应⑥______________________________。
(4)写出反应②和④的化学方程式:
②___________________________________,
④___________________________________。
解析:由两种非金属构成的化合物C和水反应生成E和F,往E溶液中加硝酸银得不溶于硝酸的白色沉淀G,则G为氯化银。另一种非金属元素与OH-组合得F,又由于F![]() H
H ![]() I
I![]() F,则F为H4SiO4或H2SiO3,化合物C为SiCl4,依题意可推出其他单质和化合物。
F,则F为H4SiO4或H2SiO3,化合物C为SiCl4,依题意可推出其他单质和化合物。
答案:(1)Cl2 H4SiO4(H2SiO3)
(2)原子 (3)Cl-+Ag+=AgCl↓
SiO2+2OH-=![]() +H2O
+H2O
![]() +2CO2+2H2O=H2SiO3↓+2
+2CO2+2H2O=H2SiO3↓+2![]()
(4)SiCl4+8NH3=Si(NH2)4+4NH4Cl
3Si(NH2)4![]() Si3N4+8NH3↑
Si3N4+8NH3↑

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如下表;J元素最低负化合价的绝对值与其原子最外层电子数相等
|
|
|
J |
|
|
|
|
|
|
|
R |
M的气态原子逐个失去1~ 4个电子所需能量(电离能)如下表所示,
|
|
I1 |
I2 |
I3 |
I4 |
…… |
|
电离能(kJ/mol) |
578 |
1817 |
2745 |
11578 |
…… |
(1)M的电子排布式为________;元素T在周期表中的位置为________。
(2)J和氢能形成多种化合物,其中分子成直线型的,且相对分子质量最小的物质的结构式为________。
(3)M和T形成的化合物在潮湿的空气中冒白雾,反应的化学方程式为_________________。
(4)由J、R形成的液态化合物JR2 0.2 mol在O2中完全燃烧,生成两种气态氧化物,298 K时放出热量215 kJ。该反应的热化学方程式为________。
(5)能源材料已成为当今科学研究的热点。氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。继C60后,科学家又合成了Si60、N60,下列有关说法正确的是_______(填序号)。
a. C60、Si60、N60都属于新型化合物
b. C60、Si60、N60互为同分异构体
c. 已知N60结构与C60相似,由于N-N键能小于N≡N,故N60的稳定性弱于N2
d. 已知金刚石中C-C键长154pm,C60中C-C键长145~140pm,故C60熔点高于金刚石