题目内容
(2010?泰州三模)烟气的脱硫(除SO2)技术和脱硝(除NOx)技术都是环境科学研究的热点.
(1)烟气脱硫、脱硝的环境意义是
(2)选择性催化还原法的脱硝原理为:6NOx+4x NH3
(3+2x)N2+6xH2O
①上述反应中每转移3mol电子,生成标准状况下N2的体积为
L.
②已知:2H2(g)+O2(g)=2H2O (g)△H=-483.6kJ?mol-1
N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ?mol-1
N2(g)+O2(g)=2NO(g)△H=-180.5kJ?mol-1
则反应6NO(g)+4NH3(g)=5N2(g)+6H2O(g)的△H=
(3)目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如下图1,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图2所示.
①写出该脱硝原理总反应的化学方程式:
②为达到最佳脱硝效果,应采取的条件是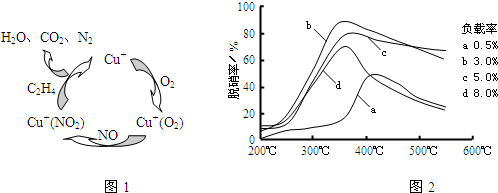
(1)烟气脱硫、脱硝的环境意义是
防止酸雨的发生
防止酸雨的发生
.(2)选择性催化还原法的脱硝原理为:6NOx+4x NH3
| ||
①上述反应中每转移3mol电子,生成标准状况下N2的体积为
| 16.8+11.2x |
| x |
| 16.8+11.2x |
| x |
②已知:2H2(g)+O2(g)=2H2O (g)△H=-483.6kJ?mol-1
N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ?mol-1
N2(g)+O2(g)=2NO(g)△H=-180.5kJ?mol-1
则反应6NO(g)+4NH3(g)=5N2(g)+6H2O(g)的△H=
-724.5kJ?mol-1
-724.5kJ?mol-1
.(3)目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如下图1,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图2所示.
①写出该脱硝原理总反应的化学方程式:
6NO+3O2+2C2H4
3N2+4CO2+4H2O
| ||
6NO+3O2+2C2H4
3N2+4CO2+4H2O
.
| ||
②为达到最佳脱硝效果,应采取的条件是
350℃、负载率3%
350℃、负载率3%
.
分析:(1)烟气脱硫、脱硝可以防止酸雨的发生;
(2)①反应中氨气中的N元素由-3价升高为0价,据此计算转移3mol电子参加反应的氨气的物质的量,再根据方程式计算生成的氮气,根据V=nVm计算氮气的体积;
②根据盖斯定律,利用已知热化学方程式乘以合适的系数进行加减,反应热也乘以相应的系数进行相应的计算;
(2)①图1可知,在催化剂的作用下,C2H4与NO、O2反应最终生成N2、CO2、H2O;
②为达到最佳脱硝效果,应满足脱硝率高,负载率低,适宜的温度.
(2)①反应中氨气中的N元素由-3价升高为0价,据此计算转移3mol电子参加反应的氨气的物质的量,再根据方程式计算生成的氮气,根据V=nVm计算氮气的体积;
②根据盖斯定律,利用已知热化学方程式乘以合适的系数进行加减,反应热也乘以相应的系数进行相应的计算;
(2)①图1可知,在催化剂的作用下,C2H4与NO、O2反应最终生成N2、CO2、H2O;
②为达到最佳脱硝效果,应满足脱硝率高,负载率低,适宜的温度.
解答:解:(1)烟气脱硫、脱硝可以防止酸雨的发生;
故答案为:防止酸雨的发生;
(2))①反应中氨气中的N元素由-3价升高为0价,转移3mol电子参加反应的氨气的物质的量为
=1mol,根据方程式可知生成的氮气的物质的量为
=
mol,氮气的体积为
mol×22.4L/mol=
L,
故答案为:
;
②、已知:①2H2(g)+O2(g)=2H2O (g)△H=-483.6kJ?mol-1
②N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ?mol-1
③N2(g)+O2(g)=2NO(g)△H=-180.5kJ?mol-1
由盖斯定律,①×3-②×2-③×3得6NO(g)+4NH3(g)=5N2(g)+6H2O(g),
故△H=3×(-483.6kJ?mol-1)-2×(-92.4kJ?mol-1)-3×(-180.5kJ?mol-1)=-724.5kJ?mol-1,
故答案为:-724.5kJ?mol-1;
(3)①图1可知,在催化剂的作用下,C2H4与NO、O2反应最终生成N2、CO2、H2O,反应总方程式为6NO+3O2+2C2H4
3N2+4CO2+4H2O,
故答案为:6NO+3O2+2C2H4
3N2+4CO2+4H2O;
②由图可知,b曲线的最高点处,脱硝率高,负载率低,适宜的温度,适合条件为350℃、负载率3%,
故答案为:350℃、负载率3%.
故答案为:防止酸雨的发生;
(2))①反应中氨气中的N元素由-3价升高为0价,转移3mol电子参加反应的氨气的物质的量为
| 3mol |
| 3 |
| 1mol×(3+2x) |
| 4x |
| 3+2x |
| 4x |
| 3+2x |
| 4x |
| 16.8+11.2x |
| x |
故答案为:
| 16.8+11.2x |
| x |
②、已知:①2H2(g)+O2(g)=2H2O (g)△H=-483.6kJ?mol-1
②N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ?mol-1
③N2(g)+O2(g)=2NO(g)△H=-180.5kJ?mol-1
由盖斯定律,①×3-②×2-③×3得6NO(g)+4NH3(g)=5N2(g)+6H2O(g),
故△H=3×(-483.6kJ?mol-1)-2×(-92.4kJ?mol-1)-3×(-180.5kJ?mol-1)=-724.5kJ?mol-1,
故答案为:-724.5kJ?mol-1;
(3)①图1可知,在催化剂的作用下,C2H4与NO、O2反应最终生成N2、CO2、H2O,反应总方程式为6NO+3O2+2C2H4
| ||
故答案为:6NO+3O2+2C2H4
| ||
②由图可知,b曲线的最高点处,脱硝率高,负载率低,适宜的温度,适合条件为350℃、负载率3%,
故答案为:350℃、负载率3%.
点评:本题以烟气的脱硫和脱硝为载体,考查环境保护、氧化还原反应计算、反应热计算、方程式书写以阅读获取信息等,题目难度中等,本题注意把握数据处理和图象分析.

练习册系列答案
相关题目
 (2010?泰州三模)下列描述错误的是( )
(2010?泰州三模)下列描述错误的是( )