题目内容
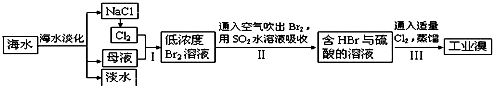
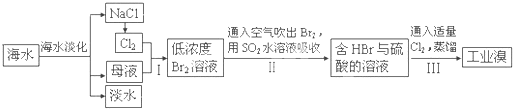
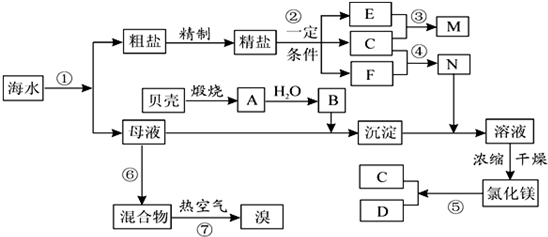
我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务,如图是海水综合利用的一个方面.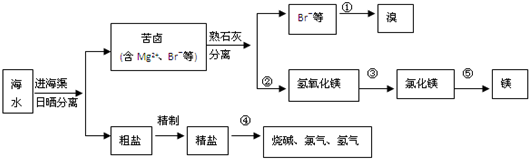
请回答下列问题:
(1)写出①反应的离子方程式:①
(2)写出④反应的离子方程式:④
(3)写出⑤反应的化学方程式:⑤
(4)日晒分离后的粗盐中含有可溶性的CaCl2、MgCl2、Na2SO4 等杂质,通 过如下几个实验步骤,精制食盐水:①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;③加入稍过量的BaCl2溶液;④滴入稀盐酸至无气泡产生;⑤过滤; 正确的操作顺序是
分析:流程分析,海水通过晒盐得到粗盐,精制后电解饱和食盐水是氯碱工业,制备氯气、烧碱;得到苦卤中主要是含有氯化镁,加入氢氧化钙沉淀分离出氢氧化镁沉淀和含溴离子的滤液,抢银行镁用盐酸溶解得到氯化镁溶液,蒸发浓缩冷却结晶得到氯化镁固体,电解熔融氯化镁得到镁,滤液中?如氯气氧化溴离子得到溴单质,通过萃取分液方法得到溴单质;
(1)反应①是氯气氧化溴离子为溴单质的反应;
(2)反应④是电解饱和食盐水生成氢氧化钠、氯气和氢气;
(3)反应⑤是电解熔融氯化镁得到镁和氯气;
(4)从电离的角度分析粗盐中的杂质可知:溶液中的杂质离子为钙离子、镁离子、和硫酸根离子,根据镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,加碳酸钠要放在加氯化钡之后,可以将钙离子和过量的钡离子沉淀,过滤要放在所有的沉淀操作之后,最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子进行分析.
(1)反应①是氯气氧化溴离子为溴单质的反应;
(2)反应④是电解饱和食盐水生成氢氧化钠、氯气和氢气;
(3)反应⑤是电解熔融氯化镁得到镁和氯气;
(4)从电离的角度分析粗盐中的杂质可知:溶液中的杂质离子为钙离子、镁离子、和硫酸根离子,根据镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,加碳酸钠要放在加氯化钡之后,可以将钙离子和过量的钡离子沉淀,过滤要放在所有的沉淀操作之后,最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子进行分析.
解答:解:流程分析,海水通过晒盐得到粗盐,精制后电解饱和食盐水是氯碱工业,制备氯气、烧碱;得到苦卤中主要是含有氯化镁,加入氢氧化钙沉淀分离出氢氧化镁沉淀和含溴离子的滤液,抢银行镁用盐酸溶解得到氯化镁溶液,蒸发浓缩冷却结晶得到氯化镁固体,电解熔融氯化镁得到镁,滤液中?如氯气氧化溴离子得到溴单质,通过萃取分液方法得到溴单质,
(1)反应①是氯气氧化溴离子为溴单质的反应,反应离子方程式为:Cl2+2Br-=Br2+2Cl-;
故答案为:Cl2+2Br-=Br2+2Cl-;
(2)反应④是电解饱和食盐水生成氢氧化钠、氯气和氢气,反应的离子方程式为:2Cl-+2H2O
2OH-+Cl2↑+H2↑;
故答案为:2Cl-+2H2O
2OH-+Cl2↑+H2↑;
(3)反应⑤是电解熔融氯化镁得到镁和氯气,反应的化学方程式为:MgCl2
Mg+Cl2↑;
故答案为:MgCl2
Mg+Cl2↑;
(4)首先要把粗盐溶于水形成溶液,然后加沉淀剂,镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可以将镁离子沉淀,硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,加入的碳酸钠必须要放在加入的氯化钡之后,保证碳酸钠会将钙离子和过量的钡离子沉淀,用过量的NaOH溶液沉淀镁离子放在过滤之前的哪一位置均可,待离子都沉淀后再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,最后经蒸发操作得到较纯净的氯化钠,所以正确的顺序为③②①⑤④或②③①⑤④或③①②⑤④,
故答案为:③②①⑤④或②③①⑤④或③①②⑤④;
(1)反应①是氯气氧化溴离子为溴单质的反应,反应离子方程式为:Cl2+2Br-=Br2+2Cl-;
故答案为:Cl2+2Br-=Br2+2Cl-;
(2)反应④是电解饱和食盐水生成氢氧化钠、氯气和氢气,反应的离子方程式为:2Cl-+2H2O
| ||
故答案为:2Cl-+2H2O
| ||
(3)反应⑤是电解熔融氯化镁得到镁和氯气,反应的化学方程式为:MgCl2
| ||
故答案为:MgCl2
| ||
(4)首先要把粗盐溶于水形成溶液,然后加沉淀剂,镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可以将镁离子沉淀,硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,加入的碳酸钠必须要放在加入的氯化钡之后,保证碳酸钠会将钙离子和过量的钡离子沉淀,用过量的NaOH溶液沉淀镁离子放在过滤之前的哪一位置均可,待离子都沉淀后再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,最后经蒸发操作得到较纯净的氯化钠,所以正确的顺序为③②①⑤④或②③①⑤④或③①②⑤④,
故答案为:③②①⑤④或②③①⑤④或③①②⑤④;
点评:本题考查了海水资源的利用,各种成分的提取方法和反应过程,除杂问题是化学实验中的一类重要问题,除杂时不仅要能把杂质除掉,还不能引入新杂质,而且方法要简便易行,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目