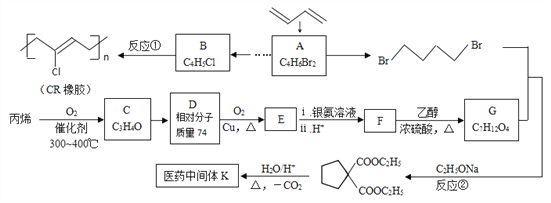
题目内容
【题目】世界水产养殖协会网介绍了一种利用电化学原理净化鱼池中水质的方法,其装置如图所示。
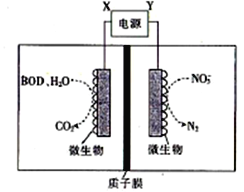
下列说法错误的是
A. X为电源正极
B. 若该装置在高温下进行,则净化效率将降低
C. 若BOD为葡萄糖(C6H12O6),则1mol葡萄糖被完全氧化时,理论上电极上流出24mole-
D. 若有1molNO3-被还原,则有6molH+通过质子膜迁移至阴极区
【答案】D
【解析】试题分析:由图中信息可知,与Y电极所连的电极上硝酸根离子被还原为氮气,所以该电极为阴极、Y为负极,则X为电源正极,微生物是催化剂。A. 由图可知,与Y电极所连的电极上硝酸根离子被还原为氮气,所以该电极为阴极、Y为负极,则X为电源正极,A正确;B. 若该装置在高温下进行,则微生物被灭活,净化效率将降低,B正确;C. 若BOD为葡萄糖(C6H12O6),则1mol葡萄糖被完全氧化时,C的化合价由0价升高到+4,理论上电极上流出24mole-,C正确;D. 若有1molNO3-被还原,由阴极的电极反应式(2NO3-+10e-+12H+=N2↑+6H2O)可知,电子转移只有5mol,所以有5molH+通过质子膜迁移至阴极区,D不正确。本题选D。

【题目】碳、氮及其化合物在工农业生产生活中有着重要作用。请回答下列问题:
(1)汽车尾气中的处理NO的方法也可用H2将NO还原为N2。
已知: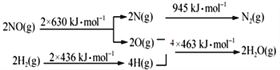
H2还原NO生成氮气和水蒸气的热化学方程是_______________________________。
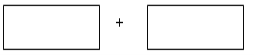
(2)高炉炼铁产生的高炉气中含有CO、H2、CO2等气体,利用CO和H2在催化剂作用下合成甲醇,是减少污染、节约能源的一种新举措,反应原理为CO(g)+2H2(g)![]() CH3OH(g) ΔH。在体积不同的两个恒容密闭容器中分别充入1molCO和2mol H2,测得平衡混合物中CH3OH 的体积分数在不同压强下随温度的变化如图。
CH3OH(g) ΔH。在体积不同的两个恒容密闭容器中分别充入1molCO和2mol H2,测得平衡混合物中CH3OH 的体积分数在不同压强下随温度的变化如图。
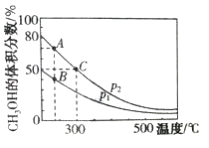
①上述合成甲醇的反应是__________________(填“吸热”或“放热”)反应,图像中的压强p1、p2的大小关系是_______________,判断的理由是________________________。
②从上图A、B、C三点中选填下表物理量对应最大的点(用“A”、“B”或“C”填写)。
反应速率V | 平衡常数K | 平衡转化率a |
____________ | _____________ | _____________ |
③在300℃时,向C点平衡体系中再充入0.25molCO、0.5molH2和0.25molCH3OH。该平衡_________(填“向正反应方向”、“向逆反应方向”或“不”)移动。
(3)有利于提高CO平衡转化率的措施有_________________。
A.使用催化剂 B.投料比不变,增加CO的浓度
C.降低反应温度 D.通入He气体使体系的压强增大
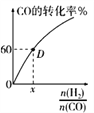
(4)一定温度下,CO的转化率与起始投料比![]() 的变化关系如图所示,测得D点氢气的转化率为40%,则x=__________________。
的变化关系如图所示,测得D点氢气的转化率为40%,则x=__________________。