题目内容
【题目】已知25℃时,CaCO3饱和溶液中c(Ca2+)为5.3×10-5 mol·L-1 MgCO3的饱和溶液中c(Mg2+)为2.6×10-3 mol·L-1。若在5 mL浓度均为0.01 mol·L-1的CaCl2和MgCl2溶液中,逐滴加入5 mL 0.012 mol·L-1 Na2CO3溶液,充分反应后过滤得到溶液M和沉淀N(不考虑溶液体积的变化)。下列观点不正确的是
A.25℃时,Ksp(CaCO3)=2.8×10-9
B.加入Na2CO3溶液的过程中,先生成CaCO3沉淀
C.滤液M中:c(Cl-)>c(Na+)>c(Mg2+)>c(CO32-)>c(OH-)
D.滤液M中:![]() =
=
【答案】D
【解析】
A.CaCO3饱和溶液中c(Ca2+)=5.3×10-5molL-1,则c(CO32-)=5.3×10-5molL-1,Ksp=c(Ca2+)×c(CO32-)=5.3×10-5×5.3×10-5=2.8×10-9,故A正确;
B.Ksp(CaCO3)=2.8×10-9,Ksp(MgCO3)=2.6×10-3×2.6×10-3=6.76×10-6,Ksp(CaCO3)较小,先生成CaCO3沉淀,故B正确;
C.在5mL浓度均为0.01molL-1的CaCl2和MgCl2的混合溶液中加入5mL0.012molL-1的Na2CO3溶液,如先不考虑离子之间的反应,混合后c(Ca2+)=0.005molL-1,(Mg2+)=0.005molL-1,c(Cl-)=0.02molL-1,c(CO32-)=0.006molL-1,c(Na+)=0.012molL-1,c(Ca2+)×c(CO32-)=3×10-5>2.8×10-9,则先生成碳酸钙沉淀,后剩余c(CO32-)=0.001molL-1,此时(Mg2+)=0.005molL-1,则c(Cl-)>c(Na+)>c(Mg2+)>c(CO32-)>c(OH-),故C正确;
D.由C可知,混合后c(Ca2+)=0.005molL-1,(Mg2+)=0.005molL-1,c(CO32-)=0.006molL-1,c(Ca2+)×c(CO32-)=3×10-5>2.8×10-9,有CaCO3沉淀生成,而c(Mg2+)×c(CO32-)=5×10-6<6.76×10-6,没有碳酸镁沉淀生成,则溶液中![]() ≠
≠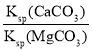 ,故D错误;
,故D错误;
故答案为D。

【题目】锰的用途非常广泛,以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴的碳酸盐及SiO2杂质)为原料生产金属锰的工艺流程如下:
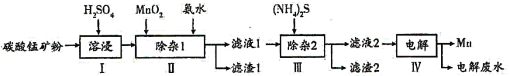
已知25℃时,部分物质的溶度积常数如下:
物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | Fe(OH)3 | MnS | CoS | NiS |
Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.1×10-36 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(1)步骤I中,为加快溶浸速率,可采取的措施是__________(至少答两条)。
(2)步骤II中,加氨水调节溶液的pH为5.0~6.0,则滤渣1的成分主要为________(填化学式);已知MnO2的作用为氧化剂,“除杂1”中涉及的离子方程式为NH3·H2O+H+=NH4++H2O、_____________、___________。
(3)步骤中,所加(NH4)2S的浓度不宜过大的原因是______________。
(4)滤液2中,c(Co2+):c(Ni2+)=____________。