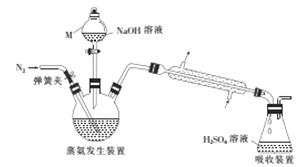
题目内容
【题目】硼和氮的单质及一些化合物在工农业生产等领域有重要应用。回答下列问题:
(1)N原子核外有___ 种不同运动状态的电子。基态N原子中,能量最高的电子所占据的原子轨道的形状为____________________________。
(2)经测定发现,N2O5固体由NO2+ 和NO3-两种离子组成,该固体中N原子杂化类型为_________;与NO2+互为等电子体的微粒有_______(写出一种)。
(3)HF和HI电离出H+较难的是________(填化学式,下同)。铵盐大多不稳定,请预测NH4F、NH4I中,较易分解的是________。
(4)第二周期中,第一电离能介于B元素和N元素间的元素为_____(填“元素符号”)。
(5)晶体硼有多种变体,但其基本结构单元都是由硼原子组成的正二十面体( 见图I),每个顶点为一个硼原子,每个三角形均为等边三角形。则每一个此基本结构单元由_______个硼原子构成;若该结构单元中有2 个原子为10B(其余为11B),那么该结构单元有_____种不同类型。
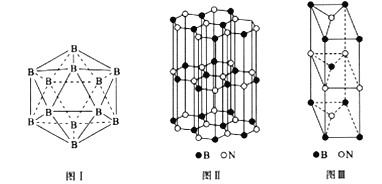
(6)硼和氮构成的一种氮化硼晶体的结构与石墨晶体结构相类似,B、N原子相互交替排列(见图II),其晶胞结构如图III所示。该晶胞有_____个B和_____个N。
【答案】 七(或“7”) 哑铃形 sp、sp2 SCN-、CO2、CS2、N3-等中的任一种 HF NH4F Be、C、O 12 3 2 2
【解析】(1)N原子核外共有7个电子,也就是有7种不同运动状态的电子。基态N原子中,能量最高的电子所占据的原子轨道为p轨道,其形状为哑铃形。
(2)NO2+ 和NO3-的中心原子的价层电对数分别为2和3,故该固体中N原子杂化类型为sp、sp2;与NO2+互为等电子体的微粒有SCN-、CO2、CS2、N3-。
(3)由于H—F键的键能较大、不易断裂、容易形成,故HF和HI相比,电离出H+较难的是HF,同理,NH4F与NH4I相比,较易分解的是NH4F。
(4) 第二周期中,第一电离能呈逐渐增大的趋势,由于Be和N原子的原子结构比其同周期邻近的两个原子稳定,故其第一电离能高于其邻近的两种元素,即B<Be<C<O<N,所以,第一电离能介于B元素和N元素间的元素为Be、C、O。
(5)由图可知,每个B参与形成5个面、每个面有3个B,共有20个面,则每一个此基本结构单元由![]() 12个硼原子构成;若该结构单元中有2 个原子为10B(其余为11B),由于B原子在结构单元中只有3种位置关系,所以该结构单元有3种不同类型。
12个硼原子构成;若该结构单元中有2 个原子为10B(其余为11B),由于B原子在结构单元中只有3种位置关系,所以该结构单元有3种不同类型。
(6)由图III可知,B原子位于晶胞的顶点,N原子位于晶胞的2个面心和4条棱上,所以该晶胞含有B的数目为![]() 2个、含有N原子的数目为
2个、含有N原子的数目为![]() 2个。
2个。