题目内容
下列排列顺序正确的是( )
| A、热稳定性强弱:HCl>HBr>HI |
| B、微粒半径:Cl->K+>Na+>Fe(OH)3胶粒 |
| C、晶体熔点:SiO2>NaCl>CF4>CCl4 |
| D、氢化物的沸点:H2Se>H2S>H2O |
考点:非金属在元素周期表中的位置及其性质递变的规律,元素周期律的作用
专题:元素周期律与元素周期表专题
分析:A.非金属性越强,气态氢化物越稳定;
B.离子半径小于胶体粒子半径,离子的电子层越多,半径越大;具有相同排布的离子原子序数大的离子半径小;
C.一般来说,熔点为原子晶体>离子晶体>分子晶体,分子晶体中相对分子质量大的熔沸点高;
D.同主族的氢化物的相对分子质量越大,沸点越大,但含氢键的物质沸点最大.
B.离子半径小于胶体粒子半径,离子的电子层越多,半径越大;具有相同排布的离子原子序数大的离子半径小;
C.一般来说,熔点为原子晶体>离子晶体>分子晶体,分子晶体中相对分子质量大的熔沸点高;
D.同主族的氢化物的相对分子质量越大,沸点越大,但含氢键的物质沸点最大.
解答:
解:A.非金属性Cl>Br>I,气态氢化物的稳定性为HCl>HBr>HI,故A正确;
B.离子半径小于胶体粒子半径,离子的电子层越多,半径越大;具有相同排布的离子原子序数大的离子半径小,则微粒半径为Fe(OH)3胶粒>Cl->K+>Na+,故B错误;
C.一般来说,熔点为原子晶体>离子晶体>分子晶体,分子晶体中相对分子质量大的熔沸点高,则晶体熔点:(原子晶体)SiO2>(离子晶体)NaCl>CCl4>CF4,故C错误;
D.同主族的氢化物的相对分子质量越大,沸点越大,但水中含氢键沸点最大,则氢化物的沸点为H2O>H2Se>H2S,故D错误;
故选A.
B.离子半径小于胶体粒子半径,离子的电子层越多,半径越大;具有相同排布的离子原子序数大的离子半径小,则微粒半径为Fe(OH)3胶粒>Cl->K+>Na+,故B错误;
C.一般来说,熔点为原子晶体>离子晶体>分子晶体,分子晶体中相对分子质量大的熔沸点高,则晶体熔点:(原子晶体)SiO2>(离子晶体)NaCl>CCl4>CF4,故C错误;
D.同主族的氢化物的相对分子质量越大,沸点越大,但水中含氢键沸点最大,则氢化物的沸点为H2O>H2Se>H2S,故D错误;
故选A.
点评:本题考查元素的性质及比较,为高频考点,把握同周期、同主族元素性质的变化规律为解答的关键,侧重规律性知识的考查,注意方法性知识的应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列物质能用铁制器皿盛放的是( )
| A、浓硫酸 | B、稀硫酸 |
| C、氯化铜溶液 | D、氯化铁溶液 |
下列各组离子在溶液中因发生氧化还原反应而不能大量共存的是( )
| A、NH4+、K+、Cl-、OH- |
| B、H+、Fe2+、MnO4-、Cl- |
| C、Ba2+、Na+、NO3-、SO42- |
| D、Na+、H+、CO32-、SO42- |
以下物质间的每步转化都能通过一步反应实现的是( )
①Fe→FeCl2→FeCl3 ②Fe→Fe3O4→Fe(OH)3
③Fe3O4→Fe→FeCl3 ④Fe2O3→FeCl3→FeCl2.
①Fe→FeCl2→FeCl3 ②Fe→Fe3O4→Fe(OH)3
③Fe3O4→Fe→FeCl3 ④Fe2O3→FeCl3→FeCl2.
| A、①③④ | B、②③④ |
| C、①②③ | D、②④ |
下列各组物质中,不能用酸性高锰酸钾溶液鉴别的是( )
| A、乙酸和乙醛 |
| B、丁二烯和乙烯 |
| C、苯和甲苯 |
| D、丙烯和丙烷 |
如图所示是五种短周期元素化合价与原子序数的关系,有关说法不正确的是( )
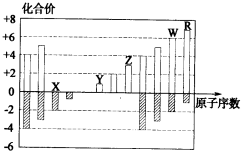

| A、原子半径:R>W>Z>Y>X |
| B、五种原子的核外最外层电子数总和为23 |
| C、X与Y可形成既含离子键又含共价键的化合物 |
| D、X、Y、W可能形成水溶液呈碱性的化合物 |
在25℃的条件下,下列各组离子一定能在指定环境中大量共存的是( )
| A、在c(H+)=10-10mol/L的溶液中:Al3+、NH4+、Cl-、NO3- |
| B、pH=13的溶液中:K+、Na+、SO32-、Cl- |
| C、pH=2的溶液中:K+、NH4+、Cl-、ClO- |
| D、甲基橙呈红色的溶液中:Fe3+、Na+、SO42-、CO32- |
下列过程或应用不涉及氧化还原反应的是( )
| A、工业上以Cl2和Ca(OH)2为原料制备漂白粉 |
| B、FeCl3溶液“腐蚀”Cu板 |
| C、Na2O2用作呼吸面具的供氧剂 |
| D、利用Al2(SO4)3和氨水反应来制取氢氧化铝 |