题目内容
将化合物A的蒸气2mol充入0.5L容器中加热,发生分解反应2A(g) B(g)+nC(g),反应到3min时,容器中A的浓度为1.6mol/L,测得这段时间内,用C的浓度变化表示的平均反应速率v(C)=1.2mol/
B(g)+nC(g),反应到3min时,容器中A的浓度为1.6mol/L,测得这段时间内,用C的浓度变化表示的平均反应速率v(C)=1.2mol/(1)化学方程式中的化学计量数n的值是______
(2)以B的浓度变化表示该反应的平均速率为______.
【答案】分析:(1)根据v=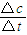 计算出3min内用物质A表示的平均反应速率,再利用速率之比等于化学计量数之比计算n;
计算出3min内用物质A表示的平均反应速率,再利用速率之比等于化学计量数之比计算n;
(2)利用速率之比等于化学计量数之比计算.
解答:解:(1)3min内用物质A表示的平均反应速率v(A)=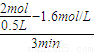 =0.8mol/(L?min),
=0.8mol/(L?min),
速率之比等于化学计量数之比,所以:
0.8mol/(L?min):1.2mol/(L?min)=2:n,
解得:n=3
故答案为:3
(2)速率之比等于化学计量数之比,所以v(B)= v(A)=
v(A)= ×0.8mol/(L?min)=0.4mol/(L?min),
×0.8mol/(L?min)=0.4mol/(L?min),
故答案为:0.4mol/(L?min)
点评:考查化学反应速率的有关计算等,难度不大,注意同一化学反应,同一时间段内,各物质的化学反应速率之比等于其计量数之比.
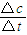 计算出3min内用物质A表示的平均反应速率,再利用速率之比等于化学计量数之比计算n;
计算出3min内用物质A表示的平均反应速率,再利用速率之比等于化学计量数之比计算n;(2)利用速率之比等于化学计量数之比计算.
解答:解:(1)3min内用物质A表示的平均反应速率v(A)=
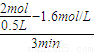 =0.8mol/(L?min),
=0.8mol/(L?min),速率之比等于化学计量数之比,所以:
0.8mol/(L?min):1.2mol/(L?min)=2:n,
解得:n=3
故答案为:3
(2)速率之比等于化学计量数之比,所以v(B)=
 v(A)=
v(A)= ×0.8mol/(L?min)=0.4mol/(L?min),
×0.8mol/(L?min)=0.4mol/(L?min),故答案为:0.4mol/(L?min)
点评:考查化学反应速率的有关计算等,难度不大,注意同一化学反应,同一时间段内,各物质的化学反应速率之比等于其计量数之比.

练习册系列答案
相关题目
 B(g)+nC(g),反应到3min时,容器中A的浓度为1.6mol/L,测得这段时间内,用C的浓度变化表示的平均反应速率v(C)=1.2mol/(L?min)
B(g)+nC(g),反应到3min时,容器中A的浓度为1.6mol/L,测得这段时间内,用C的浓度变化表示的平均反应速率v(C)=1.2mol/(L?min)