题目内容
【题目】氯化亚铜(CuCl) 为白色粉末,其露置于空气中易被氧化为绿色的碱式氯化铜Cu2(OH)3Cl]。某兴趣小组高温加热分解氯化铜晶体(CuCl2·xH 2O)制备CuCl,其装置如下(加热仪器、夹持仪器省略)
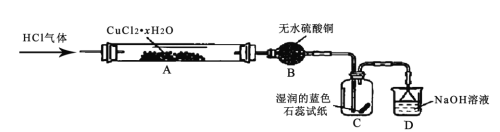
回答下列问题:
(1)装有无水硫酸铜的仪器名称为______,装置 D 的作用是______。
(2)通入 HCl 气体的主要作用是______。
(3)实验过程中,装置C 中的现象为______。
(4)硬质玻璃管A 中发生主要反应的化学方程式为__________。
(5)为测定 CuCl2·xH 2O 中结晶水的数目 x,实验步骤如下:
a 用电子天平称取一定质量的氯化铜晶体;
b 在坩埚中充分灼烧;
c 在干燥器中冷却;
d 称量所得黑色固体质量;
e 重复 b~d 操作直至连续两次称量差值不超过 0.001g。
①若氯化铜晶体质量为 3.384g,最终得到黑色固体质量为 1.600g,则 x=______(精确到 0.1)。
②若加热时有固体溅出坩埚,则测得x 值______填“偏大”“不变”或“偏小”)。
【答案】球形干燥管 吸收Cl2、HCl,防止污染空气 抑制 CuCl2 的水解,并带走水蒸气以及推除装置中空气(不写抑制 CuCl2 水解不给分) 先变红,后褪色 2CuCl2xH2O ![]() 2CuCl+Cl2↑ +2xH2O 1.9 偏大
2CuCl+Cl2↑ +2xH2O 1.9 偏大
【解析】
根据已知信息,热分解![]() 制备CuCl,为抑制水解,气体入口需要通入HCl气体,然后加热A处试管,B处球形干燥管中无水硫酸铜变蓝,可以知道
制备CuCl,为抑制水解,气体入口需要通入HCl气体,然后加热A处试管,B处球形干燥管中无水硫酸铜变蓝,可以知道![]() 分解生成了水,由于
分解生成了水,由于![]() 分解生成氯气,因此C处湿润的蓝色石蕊试纸先变红后褪色,D中NaOH溶液可以吸收尾气,防止污染,据此分析回答。
分解生成氯气,因此C处湿润的蓝色石蕊试纸先变红后褪色,D中NaOH溶液可以吸收尾气,防止污染,据此分析回答。
(1)装有无水硫酸铜的仪器名称为球形干燥管;装置 D中NaOH溶液可以吸收Cl2、HCl,防止污染空气,故答案为:球形干燥管;吸收Cl2、HCl,防止污染空气;
(2)![]() 加热时会水解生成碱式氯化铜,通入 HCl 气体的主要作用是抑制 CuCl2 的水解,并带走水蒸气以及推除装置中空气,故答案为:抑制 CuCl2 的水解,并带走水蒸气以及推除装置中空气;
加热时会水解生成碱式氯化铜,通入 HCl 气体的主要作用是抑制 CuCl2 的水解,并带走水蒸气以及推除装置中空气,故答案为:抑制 CuCl2 的水解,并带走水蒸气以及推除装置中空气;
(3)根据上述分析加热分解![]() 时生成Cl2,Cl2遇水生成盐酸和次氯酸,具有酸性和漂白性,C处湿润的蓝色石蕊试纸先变红后褪色,故答案为:先变红,后褪色;
时生成Cl2,Cl2遇水生成盐酸和次氯酸,具有酸性和漂白性,C处湿润的蓝色石蕊试纸先变红后褪色,故答案为:先变红,后褪色;
(4)![]() 高温分解生成CuCl、 Cl2、和H2O,则化学方程式为
高温分解生成CuCl、 Cl2、和H2O,则化学方程式为![]() ,故答案为:
,故答案为:![]() ;
;
(5)①最终得到黑色固体为CuO,物质的量为![]() ,由关系式
,由关系式![]() 可知
可知![]() ,解得x=1.9,故答案为:1.9;②若加热时有固体溅出坩埚则最终称量CuO质量偏小,则计算时x偏大,故答案为:偏大。
,解得x=1.9,故答案为:1.9;②若加热时有固体溅出坩埚则最终称量CuO质量偏小,则计算时x偏大,故答案为:偏大。

【题目】下列各组物质中,不满足组内任意两种物质在一定条件下均能发生反应的是
| 甲 | 乙 | 丙 |
A | Al | HCl | NaOH |
B | NH3 | O2 | HNO3 |
C | SiO2 | NaOH | HF |
D | SO2 | Ca(OH)2 | NaHCO3 |
A.AB.BC.CD.D






