��Ŀ����
����Ŀ����3molA�����1.5molB������3L�������л�ϲ���һ�������������·�Ӧ�� 2A(g)+B(g) ![]() 2C(g)����2s����C��Ũ��Ϊ0.3mol/L�������м�����ȷ���ǣ�
2C(g)����2s����C��Ũ��Ϊ0.3mol/L�������м�����ȷ���ǣ�
����A��ʾ��ƽ����Ӧ����Ϊ0.3mol/��L��s��
��2sʱ����A��Ũ��Ϊ0.7mol/L
����B��ʾ��ƽ����Ӧ����Ϊ0.15mol/��L��s��
��2sʱ����B��ת����Ϊ30��
A. �ڢ�B. �٢�C. �ڢ�D. �٢�
���𰸡�A
��������
�����ĵ�A��Ũ��Ϊ0.3mol��L��1��v(A)=![]() mol/(L��s)=0.15 mol/(L��s)���ʴ���
mol/(L��s)=0.15 mol/(L��s)���ʴ���
������A��Ũ��Ϊ0.3mol��L��1����2sʱA��Ũ��Ϊ(![]() ��0.3)mol��L��1=0.7mol��L��1������ȷ��
��0.3)mol��L��1=0.7mol��L��1������ȷ��
�۸��ݻ�ѧ��Ӧ����֮��=��ѧ������֮�ȣ�v(B)= ![]() V(A) =0.075mol/(L��s)���ʴ���
V(A) =0.075mol/(L��s)���ʴ���
��2sʱ����B��ת����Ϊ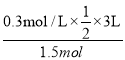 ��100%=30%������ȷ��
��100%=30%������ȷ��
��ѡA��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д� Ŀ�����ϵ�д�
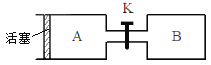
Ŀ�����ϵ�д�����Ŀ���屽��һ�ֻ���ԭ����ʵ�����ñ���Һ��ϳ��屽��װ��ʾ��ͼ����(�г���������ȥ)����ش��������⡣
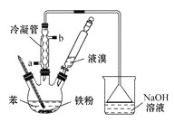
(1)��ȡ�屽�Ļ�ѧ����ʽ�� ___________����Ӧ��������ƿ���а�������������Ϊ������________���塣
(2)��ʵ�����õ����������ɴ˲��������屽�ķ�Ӧ����________��Ӧ(��������������������)��ʹ��������ʱ,��ˮ��Ӧ��______(����a������b��)��
(3)��ʵ���н�Һ��ȫ�����뱽������ַ�Ӧ��Ϊ�ᴿ�屽���������²���:
�ٽ���ƿ�е�Һ�嵹���ձ��У�Ȼ�����ձ��м�������ˮ�����ˣ���ȥδ��Ӧ����м������ʱ�����õ��IJ����������ձ�����������____________��
����Һ�پ�һϵ�д��������յõ��Ĵ��屽���Ժ�����������Ҫ��һ���ᴿ�屽���ɽ��еIJ�����_____(����ĸ)��
���� | �� | �屽 |
�е�/�� | 80 | 156 |
ˮ���ܽ��� | �� | �� |
a.ϴ�ӡ�������b.���ˡ�������c.���� d.�ᾧ