题目内容
制备锌印刷电路板是用稀硝酸腐蚀锌板,产生的废液称“烂板液”。“烂板液”中含硝酸锌外,还含有自来水带入的Cl—和Fe3+。在实验室里,用“烂板液”制取ZnSO4·7H2O的过程如下:

(1)若稀硝酸腐蚀锌板时还原产物为N2O,氧化剂与还原剂的物质的量之比是 。
(2)若步骤①的pH>12,则Zn(OH)2溶解生成四羟基合锌酸钠。写出Zn(OH)2被溶解的离子方程式 。
(3)滤液D中除了含有OH—离子外,还含有的阴离子有 (填离子符号)。
(4)若滤液E的pH=4,c(Zn2+)=2mol·L-1,c(Fe3+)=2.6×l0-9mol·L-1,能求得的溶度积是 (填选项)。
A.Ksp[Zn(OH)2] B.Ksp[Zn(OH)2]和Ksp[Fe(OH)3] C.Ksp[Fe(OH)3]
(5)步骤③要控制pH在一定范围。实验室用pH试纸测定溶液pH的方法是: 。
(6)已知:①Fe(OH)3(s) Fe3+(aq)+3OH-(aq) ; ΔH=" a" kJ?mol-1
Fe3+(aq)+3OH-(aq) ; ΔH=" a" kJ?mol-1
②H2O(l) H+(aq)+OH-(aq) ;ΔH=" b" kJ?mol-1
H+(aq)+OH-(aq) ;ΔH=" b" kJ?mol-1
请写出Fe3+发生水解反应的热化学方程式: 。
若①的溶度积常数为KSP,②的离子积常数为KW,Fe3+发生水解反应的平衡常数:
K= 。(用含KSP、KW的代数式表示)

(1)若稀硝酸腐蚀锌板时还原产物为N2O,氧化剂与还原剂的物质的量之比是 。
(2)若步骤①的pH>12,则Zn(OH)2溶解生成四羟基合锌酸钠。写出Zn(OH)2被溶解的离子方程式 。
(3)滤液D中除了含有OH—离子外,还含有的阴离子有 (填离子符号)。
(4)若滤液E的pH=4,c(Zn2+)=2mol·L-1,c(Fe3+)=2.6×l0-9mol·L-1,能求得的溶度积是 (填选项)。
A.Ksp[Zn(OH)2] B.Ksp[Zn(OH)2]和Ksp[Fe(OH)3] C.Ksp[Fe(OH)3]
(5)步骤③要控制pH在一定范围。实验室用pH试纸测定溶液pH的方法是: 。
(6)已知:①Fe(OH)3(s)
 Fe3+(aq)+3OH-(aq) ; ΔH=" a" kJ?mol-1
Fe3+(aq)+3OH-(aq) ; ΔH=" a" kJ?mol-1②H2O(l)
 H+(aq)+OH-(aq) ;ΔH=" b" kJ?mol-1
H+(aq)+OH-(aq) ;ΔH=" b" kJ?mol-1请写出Fe3+发生水解反应的热化学方程式: 。
若①的溶度积常数为KSP,②的离子积常数为KW,Fe3+发生水解反应的平衡常数:
K= 。(用含KSP、KW的代数式表示)
(1)1:2
(2)Zn(OH)2+2OH-=ZnO22-+2H2O
(3)Cl-、NO3-
(4)C
(5)将pH试纸放在玻璃片上,用玻璃棒醮取待测点在试纸中间,待颜色变化稳定后与比色卡对比,读出读数
(6)Fe3+(aq) +3H2O(l) Fe(OH)3(s) +3H+(aq) △H=(3b-a)kJ·mol-1
Fe(OH)3(s) +3H+(aq) △H=(3b-a)kJ·mol-1 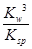
(2)Zn(OH)2+2OH-=ZnO22-+2H2O
(3)Cl-、NO3-
(4)C
(5)将pH试纸放在玻璃片上,用玻璃棒醮取待测点在试纸中间,待颜色变化稳定后与比色卡对比,读出读数
(6)Fe3+(aq) +3H2O(l)
 Fe(OH)3(s) +3H+(aq) △H=(3b-a)kJ·mol-1
Fe(OH)3(s) +3H+(aq) △H=(3b-a)kJ·mol-1 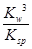
试题分析:(1)4Zn+10HNO3
 4Zn(NO3)2+N2O+5H2O,HNO3做氧化剂,但是10molHNO3里面发生化合价改变只有2mol,Zn做还原剂,所以氧化剂与还原剂的物质的量之比是1 :2。
4Zn(NO3)2+N2O+5H2O,HNO3做氧化剂,但是10molHNO3里面发生化合价改变只有2mol,Zn做还原剂,所以氧化剂与还原剂的物质的量之比是1 :2。(2)偏铝酸钠在水溶液中都是以Na[Al(OH)4]的形式存在,以前只不过是为了方便,把它简写成NaAlO2。但它的实际组成还是Na[Al(OH)4]。 NaAlO2偏铝酸钠是简写,就像氢离子(H+)实际上是水合氢离子一样。[Zn(OH)4]-与此相类似。
(4)在一定条件下,难溶强电解质AmBn溶于水形成饱和溶液时,溶质的离子与该固态物质之间建立动态平衡,叫作沉淀溶解平衡。这时,离子浓度的乘积为一常数,叫作溶度积,用Ksp表示。很明显,滤液E的pH=4时,Zn(OH)2已经溶解,所以无法求得溶度积,而Fe(OH)3是已沉淀形式存在,所以可以求得。
(6)由②×3-①即可得到Fe3+(aq) +3H2O(l)
 Fe(OH)3(s) +3H+(aq) △H=(3b-a)kJ·mol-1 。
Fe(OH)3(s) +3H+(aq) △H=(3b-a)kJ·mol-1 。Ksp[Fe(OH)3]=c(Fe3+)·c3(OH-) KW=c(OH-)·c(H+)
Fe3+发生水解反应的平衡常数:K=
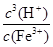 =
=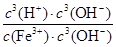 =
=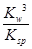

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案
相关题目
 2H2(g)+O2(g) ΔH1
2H2(g)+O2(g) ΔH1 O2+HbCO,实验表明,c(HbCO)即使只有c(HbO2)的
O2+HbCO,实验表明,c(HbCO)即使只有c(HbO2)的 ,也可造成人的智力损伤。已知t ℃时上述反应的平衡常数K=200,吸入肺部O2的浓度约为1.0×10-2 mol·L-1,若使c(HbCO)小于c(HbO2)的
,也可造成人的智力损伤。已知t ℃时上述反应的平衡常数K=200,吸入肺部O2的浓度约为1.0×10-2 mol·L-1,若使c(HbCO)小于c(HbO2)的 CO2 (g)+ H2(g) ΔH 2 = ?41 kJ/mol,起始时在密闭容器中充入1.00 molCO和1.00 molH2O,分别进行以下实验,探究影响平衡的因素(其它条件相同且不考虑任何副反应的影响)。实验条件如下表:
CO2 (g)+ H2(g) ΔH 2 = ?41 kJ/mol,起始时在密闭容器中充入1.00 molCO和1.00 molH2O,分别进行以下实验,探究影响平衡的因素(其它条件相同且不考虑任何副反应的影响)。实验条件如下表:
 N2O4(g) ΔH=" -" 52.7kJ·mol-1
N2O4(g) ΔH=" -" 52.7kJ·mol-1

 (m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+xO2 mCeO2+xH2+xCO
mCeO2+xH2+xCO
 CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CH3OH的物质的量随时间的变化如图所示,请回答下列问题:
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CH3OH的物质的量随时间的变化如图所示,请回答下列问题:

