题目内容
2012年11月16日,5名男孩被发现死于贵州省毕节市七星关区街头垃圾箱内,经当地公安部门初步调查,5名男孩是因在垃圾箱内生火取暖导致CO中毒而死亡。
(1)CO中毒是由于CO与血液中血红蛋白的血红素部分反应生成碳氧血红蛋白,反应的化学方程式可表示为CO+HbO2 O2+HbCO,实验表明,c(HbCO)即使只有c(HbO2)的
O2+HbCO,实验表明,c(HbCO)即使只有c(HbO2)的 ,也可造成人的智力损伤。已知t ℃时上述反应的平衡常数K=200,吸入肺部O2的浓度约为1.0×10-2 mol·L-1,若使c(HbCO)小于c(HbO2)的
,也可造成人的智力损伤。已知t ℃时上述反应的平衡常数K=200,吸入肺部O2的浓度约为1.0×10-2 mol·L-1,若使c(HbCO)小于c(HbO2)的 ,则吸入肺部CO的浓度不能超过______mol·L-1。
,则吸入肺部CO的浓度不能超过______mol·L-1。
(2)有如下三个与CO相关的反应:
Fe(s)+CO2(g) FeO(s)+CO(g) ΔH=Q1,平衡常数K1
FeO(s)+CO(g) ΔH=Q1,平衡常数K1
Fe(s)+H2O(g) FeO(s)+H2(g) ΔH=Q2,平衡常数为K2
FeO(s)+H2(g) ΔH=Q2,平衡常数为K2
H2(g)+CO2(g) CO(g)+H2O(g) ΔH=Q3,平衡常数为K3
CO(g)+H2O(g) ΔH=Q3,平衡常数为K3
在不同的温度下K1、K2、K3的数值如下:
请回答下列问题:
①Q1、Q2、Q3的关系式:Q3=________。
②K1、K2、K3的关系式:K3=________,根据此关系式可计算出上表中900 ℃时,K3的数值为________(精确到小数点后两位)。可进一步推断反应H2(g)+CO2(g) CO(g)+H2O(g)为________(填“放”或“吸”)热反应,Q3________0(填“>”、“<”或“=”)。③改变条件使可逆反应H2(g)+CO2(g)
CO(g)+H2O(g)为________(填“放”或“吸”)热反应,Q3________0(填“>”、“<”或“=”)。③改变条件使可逆反应H2(g)+CO2(g) CO(g)+H2O(g)已经建立的平衡逆向移动,可采取的措施有________。
CO(g)+H2O(g)已经建立的平衡逆向移动,可采取的措施有________。
A.缩小容器体积 B.降低温度
C.使用催化剂 D.设法增加H2O(g)的量
E.升高温度
(3)在一定条件下,使CO和O2的混合气体13 g充分反应,所得混合气体在常温下与足量的Na2O2固体反应,结果固体增重7 g,则原混合气体中CO的质量是________g。
(1)CO中毒是由于CO与血液中血红蛋白的血红素部分反应生成碳氧血红蛋白,反应的化学方程式可表示为CO+HbO2
 O2+HbCO,实验表明,c(HbCO)即使只有c(HbO2)的
O2+HbCO,实验表明,c(HbCO)即使只有c(HbO2)的 ,也可造成人的智力损伤。已知t ℃时上述反应的平衡常数K=200,吸入肺部O2的浓度约为1.0×10-2 mol·L-1,若使c(HbCO)小于c(HbO2)的
,也可造成人的智力损伤。已知t ℃时上述反应的平衡常数K=200,吸入肺部O2的浓度约为1.0×10-2 mol·L-1,若使c(HbCO)小于c(HbO2)的 ,则吸入肺部CO的浓度不能超过______mol·L-1。
,则吸入肺部CO的浓度不能超过______mol·L-1。(2)有如下三个与CO相关的反应:
Fe(s)+CO2(g)
 FeO(s)+CO(g) ΔH=Q1,平衡常数K1
FeO(s)+CO(g) ΔH=Q1,平衡常数K1Fe(s)+H2O(g)
 FeO(s)+H2(g) ΔH=Q2,平衡常数为K2
FeO(s)+H2(g) ΔH=Q2,平衡常数为K2H2(g)+CO2(g)
 CO(g)+H2O(g) ΔH=Q3,平衡常数为K3
CO(g)+H2O(g) ΔH=Q3,平衡常数为K3在不同的温度下K1、K2、K3的数值如下:
| T/℃ | K1 | K2 | K3 |
| 700 | 1.47 | 2.38 | 0.62 |
| 900 | 2.15 | 1.67 | |
请回答下列问题:
①Q1、Q2、Q3的关系式:Q3=________。
②K1、K2、K3的关系式:K3=________,根据此关系式可计算出上表中900 ℃时,K3的数值为________(精确到小数点后两位)。可进一步推断反应H2(g)+CO2(g)
 CO(g)+H2O(g)为________(填“放”或“吸”)热反应,Q3________0(填“>”、“<”或“=”)。③改变条件使可逆反应H2(g)+CO2(g)
CO(g)+H2O(g)为________(填“放”或“吸”)热反应,Q3________0(填“>”、“<”或“=”)。③改变条件使可逆反应H2(g)+CO2(g) CO(g)+H2O(g)已经建立的平衡逆向移动,可采取的措施有________。
CO(g)+H2O(g)已经建立的平衡逆向移动,可采取的措施有________。A.缩小容器体积 B.降低温度
C.使用催化剂 D.设法增加H2O(g)的量
E.升高温度
(3)在一定条件下,使CO和O2的混合气体13 g充分反应,所得混合气体在常温下与足量的Na2O2固体反应,结果固体增重7 g,则原混合气体中CO的质量是________g。
(1)1.0×10-6 (2)①Q1-Q2 ②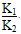 1.29 吸 > ③BD (3)7或9
1.29 吸 > ③BD (3)7或9
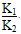 1.29 吸 > ③BD (3)7或9
1.29 吸 > ③BD (3)7或9(1)K=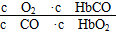 =
=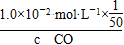 =200,所以c(CO)=1.0×10-2 moL·L-1×
=200,所以c(CO)=1.0×10-2 moL·L-1× ×
×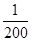 =1.0×10-6 mol·L-1。(2)①第一个热化学方程式减去第二个热化学方程式等于第三个热化学方程式,故Q3=Q1-Q2;②
=1.0×10-6 mol·L-1。(2)①第一个热化学方程式减去第二个热化学方程式等于第三个热化学方程式,故Q3=Q1-Q2;②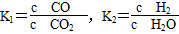 ,K3=
,K3= ,故K3=
,故K3=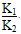 ,当T=900 ℃时,K3=
,当T=900 ℃时,K3=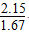 ≈1.29;温度越高,平衡常数越大,说明升高温度导致平衡正向移动,故该反应为吸热反应,即Q3>0。③该反应为反应前后气体分子数不变的反应,故改变容器体积不会使平衡移动,A项错误;因为该反应为吸热反应,降低温度可以使平衡逆向移动,B项正确、E项错误;使用催化剂不能使平衡移动,C项错误;增加生成物的浓度,可以使平衡逆向移动,D项正确。(3)CO2与过氧化钠反应的化学方程式为2CO2+2Na2O2=2Na2CO3+O2,由化学方程式可知当有88 g CO2参加反应时,固体增重为88 g-32 g=56 g,由实际增重7 g可知m(CO2)=7 g×88 g÷56 g=11 g,n(CO2)=
≈1.29;温度越高,平衡常数越大,说明升高温度导致平衡正向移动,故该反应为吸热反应,即Q3>0。③该反应为反应前后气体分子数不变的反应,故改变容器体积不会使平衡移动,A项错误;因为该反应为吸热反应,降低温度可以使平衡逆向移动,B项正确、E项错误;使用催化剂不能使平衡移动,C项错误;增加生成物的浓度,可以使平衡逆向移动,D项正确。(3)CO2与过氧化钠反应的化学方程式为2CO2+2Na2O2=2Na2CO3+O2,由化学方程式可知当有88 g CO2参加反应时,固体增重为88 g-32 g=56 g,由实际增重7 g可知m(CO2)=7 g×88 g÷56 g=11 g,n(CO2)=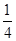 mol。若CO与氧气反应,CO不足,则n(CO)=n(CO2)=
mol。若CO与氧气反应,CO不足,则n(CO)=n(CO2)=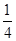 mol,m(CO)=
mol,m(CO)=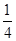 mol×28 g·mol-1=7 g。若CO与氧气反应,CO过量,则n(O2)=
mol×28 g·mol-1=7 g。若CO与氧气反应,CO过量,则n(O2)=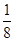 mol,故m(CO)=13 g-
mol,故m(CO)=13 g-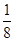 mol×32 g·mol-1=9 g。
mol×32 g·mol-1=9 g。
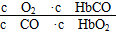 =
=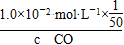 =200,所以c(CO)=1.0×10-2 moL·L-1×
=200,所以c(CO)=1.0×10-2 moL·L-1× ×
×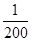 =1.0×10-6 mol·L-1。(2)①第一个热化学方程式减去第二个热化学方程式等于第三个热化学方程式,故Q3=Q1-Q2;②
=1.0×10-6 mol·L-1。(2)①第一个热化学方程式减去第二个热化学方程式等于第三个热化学方程式,故Q3=Q1-Q2;②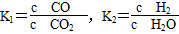 ,K3=
,K3= ,故K3=
,故K3=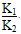 ,当T=900 ℃时,K3=
,当T=900 ℃时,K3=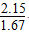 ≈1.29;温度越高,平衡常数越大,说明升高温度导致平衡正向移动,故该反应为吸热反应,即Q3>0。③该反应为反应前后气体分子数不变的反应,故改变容器体积不会使平衡移动,A项错误;因为该反应为吸热反应,降低温度可以使平衡逆向移动,B项正确、E项错误;使用催化剂不能使平衡移动,C项错误;增加生成物的浓度,可以使平衡逆向移动,D项正确。(3)CO2与过氧化钠反应的化学方程式为2CO2+2Na2O2=2Na2CO3+O2,由化学方程式可知当有88 g CO2参加反应时,固体增重为88 g-32 g=56 g,由实际增重7 g可知m(CO2)=7 g×88 g÷56 g=11 g,n(CO2)=
≈1.29;温度越高,平衡常数越大,说明升高温度导致平衡正向移动,故该反应为吸热反应,即Q3>0。③该反应为反应前后气体分子数不变的反应,故改变容器体积不会使平衡移动,A项错误;因为该反应为吸热反应,降低温度可以使平衡逆向移动,B项正确、E项错误;使用催化剂不能使平衡移动,C项错误;增加生成物的浓度,可以使平衡逆向移动,D项正确。(3)CO2与过氧化钠反应的化学方程式为2CO2+2Na2O2=2Na2CO3+O2,由化学方程式可知当有88 g CO2参加反应时,固体增重为88 g-32 g=56 g,由实际增重7 g可知m(CO2)=7 g×88 g÷56 g=11 g,n(CO2)=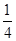 mol。若CO与氧气反应,CO不足,则n(CO)=n(CO2)=
mol。若CO与氧气反应,CO不足,则n(CO)=n(CO2)=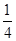 mol,m(CO)=
mol,m(CO)=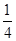 mol×28 g·mol-1=7 g。若CO与氧气反应,CO过量,则n(O2)=
mol×28 g·mol-1=7 g。若CO与氧气反应,CO过量,则n(O2)=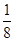 mol,故m(CO)=13 g-
mol,故m(CO)=13 g-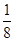 mol×32 g·mol-1=9 g。
mol×32 g·mol-1=9 g。
练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 HOI(aq) △H2
HOI(aq) △H2


 它所对应的化学反应为:__ ___
它所对应的化学反应为:__ ___ CH3OCH3(g)+ 3H2O(g)
CH3OCH3(g)+ 3H2O(g) CO(g)+H2(g);②C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
CO(g)+H2(g);②C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
 、
、 , NO2中氮氧键的键能为466 kJ·mol-1,N2O4中N-N键键能为167 kJ·mol-1,氮氧键的键能为438.5 kJ·mol-1,写出N2O4转化为NO2的热化学方程式 ;
, NO2中氮氧键的键能为466 kJ·mol-1,N2O4中N-N键键能为167 kJ·mol-1,氮氧键的键能为438.5 kJ·mol-1,写出N2O4转化为NO2的热化学方程式 ;  NiO(OH)+MH
NiO(OH)+MH
 Fe3+(aq)+3OH-(aq) ; ΔH=" a" kJ?mol-1
Fe3+(aq)+3OH-(aq) ; ΔH=" a" kJ?mol-1 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。


 N2(g)+CO2(g)+2H2O(g) ΔH1="-867" kJ/mol
N2(g)+CO2(g)+2H2O(g) ΔH1="-867" kJ/mol N2O4(g) ΔH2="-56.9" kJ/mol
N2O4(g) ΔH2="-56.9" kJ/mol

 2NH3(g)的特点,在给出的坐标图2中,画出其在1 MPa和10 MPa条件下H2的转化率随温度变化的趋势曲线示意图,并标明各条曲线的压强。
2NH3(g)的特点,在给出的坐标图2中,画出其在1 MPa和10 MPa条件下H2的转化率随温度变化的趋势曲线示意图,并标明各条曲线的压强。