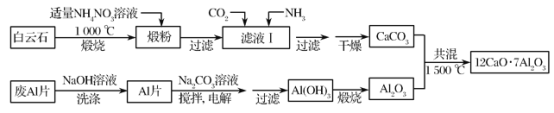
题目内容
【题目】锌钡白是一种白色颜料。工业上是由ZnSO4与BaS溶液混合而成:BaS+ZnSO4=ZnS↓+BaSO4↓。请根据以下工业生产流程回答有关问题。
Ⅰ.ZnSO4溶液的制备与提纯:

有关资料:a.菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等;
b.Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2。
(1)若②中加入氧化剂为H2O2,写出离子反应方程式____。
(2)为了达到综合利用、节能减排的目的,上述流程步骤④中的CO2可以来自于步骤___(选填①、②、③、⑤)。
(3)滤渣2的主要成分为___。
(4)写出步骤④后产生滤渣3的离子反应方程式___。
Ⅱ.BaS溶液的制备:

(5)写出煅烧还原的化学反应方程式____。
Ⅲ.制取锌钡白:
(6)如果生产流程步骤⑤硫酸过量,则ZnSO4与BaS溶液混合制取锌钡白产生的后果是___。
【答案】2Fe2++2H++H2O2=2Fe3++2H2O ① Fe(OH)3、Cu(OH)2 ZnO22-+2CO2+2H2O=Zn(OH)2↓+2HCO3- BaSO4+4C![]() BaS+4CO↑ 过量的酸与BaS溶液混合会产生有毒的H2S污染空气,而且会降低锌钡白的产率
BaS+4CO↑ 过量的酸与BaS溶液混合会产生有毒的H2S污染空气,而且会降低锌钡白的产率
【解析】
I、ZnSO4的制备流程:菱锌矿用硫酸溶解后,得到的滤渣1为SiO2,溶液中的阳离子有Zn2+、Fe2+、Cu2+,加入H2O2的目的是将Fe2+转化为Fe3+,再加入过量的NaOH,Fe3+和Cu2+形成滤渣2,而Zn2+转化为ZnO22-,留在溶液中;向所得溶液通入CO2,Na2ZnO2转化为Zn(OH)2形成滤渣3,再用硫酸溶解Zn(OH)2即得ZnSO4;
II、根据题中的反应物和生成物写出反应方程式即可;
III、BaS和过量的酸反应生成的H2S会污染环境,同时也锌钡白的产率也会降低。
(1)加入氧化剂二价铁被氧化为三价铁,若②中加入氧化剂为H2O2,反应的离子方程式为2Fe2+ +2H++H2O2 =2Fe3++2H2O;
(2)因步骤①中,硫酸与ZnCO3、FeCO3、Cu2(OH)2CO3反应时均产生CO2,为了达到综合利用、节能减排的目的,上述流程步骤④中的CO2可以来自于步骤①;
(3)根据上述分析,滤渣2的主要成分为Fe(OH)3、Cu(OH)2;
(4)由题目信息知:Zn(OH)2与Al(OH)3相似,则与Na2ZnO2与NaAlO2类似,即Na2ZnO2与过量CO2反应方程式为:Na2ZnO2+2CO2+2H2O=Zn(OH)2↓+2NaHCO3,离子方程式为;ZnO22-+2CO2+2H2O=Zn(OH)2↓+2HCO3-;
(5)根据示意图,硫酸钡与碳粉煅烧还原反应生成BaS和CO,反应的化学反应方程式为BaSO4+4C![]() BaS+4CO↑;
BaS+4CO↑;
(6)如果Ⅰ中步骤⑤使用硫酸过量,会发生如下反应,BaS+H2SO4=H2S↑+ZnSO4,H2S气体有毒,会污染环境,而且锌钡白的产率会降低。

 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案