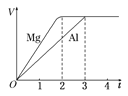
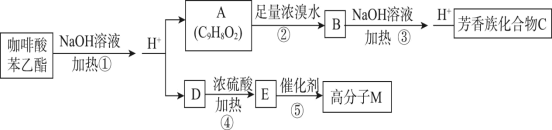
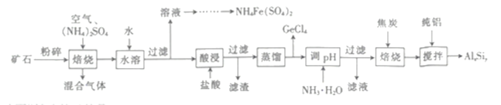
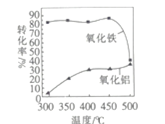
题目内容
【题目】氯氧化铜[xCuO·yCuCl2·zH2O]在农业上可用作杀菌剂。以废铜(主要杂质为Fe)为原料,经溶解氧化、调节pH、过滤等步骤,可制备氯氧化铜。
(1)工业上用H2O2和HCl溶解氧化废铜时,反应生成Cu2+时的离子方程式为________。
(2)加Cu2(OH)2CO3调节混合液pH时,其优点是________。
(3)为测定氯氧化铜的组成,现进行如下实验:
步骤Ⅰ:称取0.4470 g氯氧化铜固体,放入锥形瓶中,加入一定量30%的硝酸使固体完全溶解。滴加K2CrO4溶液作指示剂,用0.100 0 mol·L-1 AgNO3标准溶液滴定溶液中的Cl-,滴定至终点时消耗AgNO3标准溶液20.00 mL(已知Ag2CrO4为砖红色沉淀)。
步骤Ⅱ:称取0.2235 g氯氧化铜固体,放入锥形瓶中,加入一定量硫酸使固体完全溶解。溶液中加入过量的KI固体,充分反应后向溶液中滴入数滴淀粉溶液,用0.200 0 mol·L-1 Na2S2O3标准溶液滴定,滴定至终点时消耗Na2S2O3标准溶液10.00 mL。
已知步骤Ⅱ中所发生的反应如下:2Cu2++4I-===2CuI↓+I2;2Na2S2O3+I2===2NaI+Na2S4O6。
①步骤Ⅰ滴定终点时的实验现象是_____。
②通过计算确定氯氧化铜的化学式(写出计算过程)__________。
【答案】Cu+2H++H2O2===Cu2++2H2O 调节溶液的酸碱性,不引入杂质,使Fe3+全部转化为Fe(OH)3沉淀等 当加入最后一滴AgNO3溶液时,出现砖红色沉淀 0.4470g氯氧化铜Cl-离子的物质的量:n(Cl-)=n(AgNO3)=0.1000mol·L-1×0.02L=0.002mol根据题意:2Cu2+~I2~2Na2S2O3 则0.2235g氯氧化铜固体中:n(Cu2+)=n(Na2S2O3)=0.2000mol·L-1×0.01L=0.002mol可知0.4470g氯氧化铜中含有:n(CuCl2)=0.001mol,n(CuO)=0.003mol,根据质量守恒有n(H2O)=(0.4470g-0.001mol×135g·mol-1-0.003mol×80g·mol-1)÷18g·mol-1=0.004mol,n(CuO)∶n(CuCl2)∶n(H2O)=3∶1∶4,则晶体的化学式为3CuO·CuCl2·4H2O
【解析】
(1)Cu与H2O2和HCl反应的化学方程式为:![]() ,拆写成离子方程式为:Cu+2H++H2O2===Cu2++2H2O;
,拆写成离子方程式为:Cu+2H++H2O2===Cu2++2H2O;
(2)溶解氧化时,产生Fe3+,加入Cu2(OH)2CO3调节混合液pH,其优点是:调节溶液的酸碱性,不引入杂质,使Fe3+全部转化为Fe(OH)3沉淀等;
(3)①当氯离子已沉淀完全,多加入一滴AgNO3溶液时,Ag+和![]() 开始结合,出现砖红色沉淀,故答案为:当加入最后一滴AgNO3溶液时,出现砖红色沉淀;
开始结合,出现砖红色沉淀,故答案为:当加入最后一滴AgNO3溶液时,出现砖红色沉淀;
②0.4470g氯氧化铜Cl-离子的物质的量:n(Cl-)=n(AgNO3)=0.1000mol·L-1×0.02L=0.002mol根据题意:2Cu2+~I2~2Na2S2O3 则0.2235g氯氧化铜固体中:n(Cu2+)=n(Na2S2O3)=0.2000mol·L-1×0.01L=0.002mol可知0.4470g氯氧化铜中含有:n(CuCl2)=0.001mol,n(CuO)=0.003mol,根据质量守恒有n(H2O)=(0.4470g-0.001mol×135g·mol-1-0.003mol×80g·mol-1)÷18g·mol-1=0.004mol,n(CuO)∶n(CuCl2)∶n(H2O)=3∶1∶4,则晶体的化学式为3CuO·CuCl2·4H2O,故答案为:3CuO·CuCl2·4H2O。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案