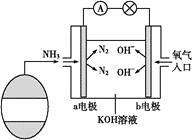
题目内容
【题目】图示代表周期表中的几种短周期元素,下列说法中错误的是()
A. ED4分子中各原子均满足8电子稳定结构
B. AD3和ED4两分子的中心原子均为sp3杂化
C. C、D气态氢化物稳定性强弱为C>D
D. A、B、C电负性大小顺序为C>A>B
【答案】D
【解析】
根据元素在周期表中的位置知,A、B、C、D、E分别是N、O、F、Cl、Si元素;
A.SiCl4分子中Si的化合价为+4价,Cl的化合价为-1价,Si原子最外层电子数为4,Cl原子最外层电子数为7,则各原子都达到了8电子稳定结构,故A正确;
B.NCl3和SiCl4两分子的中心原子价层电子对数都是4,所以均为sp3杂化,故B正确;
C.元素的非金属性越强,其气态氢化物越稳定,非金属性F>Cl,所以C、D气态氢化物稳定性强弱为C>D,故C正确;
D.元素非金属性越强电负性越强,同周期元素随着原子序数增大非金属性增强,所以电负性大小顺序为C>B>A,故D错误;
故选D。

 阅读快车系列答案
阅读快车系列答案【题目】下列实验操作,现象和结论都正确的是
选项 | 操作 | 现象 | 结论 |
A | 用坩埚钳夹一块铝箔在酒精灯上灼烧 | 铝箔熔化并滴落 | 氧化铝的熔点较低 |
B | 向亚硫酸钠溶液中滴加足量盐酸,将产生的气体通入品红溶液 | 品红溶液褪色 | 非金属性: |
C | 将用砂纸除去保护膜的镁片和铝片(大小、形状相同),分别插入同浓度的稀硫酸中 | 镁片表面产生气泡速率大于铝片 | 还原性: |
D | 常温下,将两根大小相同的铁钉分别插入浓硝酸和稀硝酸中 | 浓硝酸中无明显现象,稀硝酸中产生气泡 | 稀硝酸的氧化性比浓硝酸强 |
A.AB.BC.CD.D
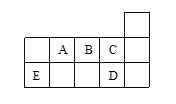
【题目】四种短周期元素X、Y、Z和W在周期表中的位置如图所示,原子序数之和为48,下列说法不正确的是
X | Y | |
Z | W |
A.原子半径(r)大小比较:![]()
B.X和Y可形成共价化合物XY、![]() 等化合物
等化合物
C.Y的非金属性比Z的强,所以Y的最高价氧化物的水化物酸性大于Z
D.Z的最低价单核阴离子的失电子能力比W的强