题目内容
【题目】取一定质量的![]() 和
和![]() 固体的混合物溶于适量的水,将所得溶液等分成两份,向其中一份中缓慢逐滴加入某浓度的盐酸,产生的气体体积与所加盐酸体积之间的关系如图所示;向另一份中加入过量的
固体的混合物溶于适量的水,将所得溶液等分成两份,向其中一份中缓慢逐滴加入某浓度的盐酸,产生的气体体积与所加盐酸体积之间的关系如图所示;向另一份中加入过量的![]() 溶液,得到白色沉淀3.94g。试回答下列问题:
溶液,得到白色沉淀3.94g。试回答下列问题:
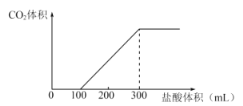
(1)盐酸的物质的量浓度为________________。
(2)固体混合物中![]() 的质量为________________。
的质量为________________。
【答案】0.1![]() 0.78g
0.78g
【解析】
考虑固体溶于水所发生的反应,分析溶质可能的组成。结合滴加盐酸的图象,判断溶质成分。最后根据元素守恒关系进行计算。
![]() 和
和![]() 固体混合物溶于水,有反应2Na2O2+2H2O=4NaOH+O2↑、NaHCO3+NaOH=Na2CO3+H2O,溶质有三种可能:NaOH和Na2CO3、只有Na2CO3、Na2CO3和NaHCO3。溶液中滴加盐酸依次发生反应:NaOH+HCl=NaCl+H2O、Na2CO3+HCl=NaCl+NaHCO3、NaHCO3+HCl=NaCl+CO2↑+H2O。图象中,第一阶段消耗的盐酸(100mL)少于第二阶段消耗的盐酸(200mL),故溶质只能为Na2CO3和NaHCO3。
固体混合物溶于水,有反应2Na2O2+2H2O=4NaOH+O2↑、NaHCO3+NaOH=Na2CO3+H2O,溶质有三种可能:NaOH和Na2CO3、只有Na2CO3、Na2CO3和NaHCO3。溶液中滴加盐酸依次发生反应:NaOH+HCl=NaCl+H2O、Na2CO3+HCl=NaCl+NaHCO3、NaHCO3+HCl=NaCl+CO2↑+H2O。图象中,第一阶段消耗的盐酸(100mL)少于第二阶段消耗的盐酸(200mL),故溶质只能为Na2CO3和NaHCO3。
(1)设原固体混合物中NaHCO3、Na2O2的物质的量分别为2a、2b,则溶于水所得溶液中(2a-4b)molNaHCO3、4bmolNa2CO3,每份溶液中(a-2b)molNaHCO3、2bmolNa2CO3。又设盐酸浓度为c,则据图象第一阶段有2b=0.1L×c,据图象第二阶段有(a-2b)+2b=0.2L×c。因溶液与过量Ba(OH)2溶液得到3.94gBaCO3,得(a-2b)+2b=3.94g/197g·mol-1=0.02mol。解得a=0.02mol、c=0.1mol·L-1、b=0.005mol。
(2)固体混合物中,m(Na2O2)=2b×78g·mol-1=0.78g。

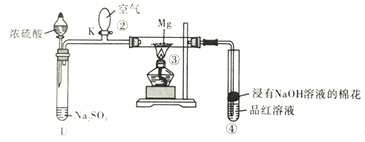
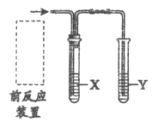
【题目】实验室用下图装置完成表中的四个实验,不能达到实验目的的是
实验装置 | 实验目的 | 试剂X | 试剂Y | |
| A. | 检验C2H5Br消去反应后的气体产物 | 水 | 酸性KMnO4溶液 |
B. | 检验C2H5OH消去反应后的气体产物 | NaOH溶液 | Br2的CCl4溶液 | |
C. | 比较醋酸、碳酸、苯酚酸性强弱 | NaOH溶液 | 苯酚钠溶液 | |
D. | 检验制取乙炔时的气体产物 | CuSO4溶液 | 酸性KMnO4溶液 |
A. AB. BC. CD. D