题目内容
某温度下,向一定体积0.1mol/L醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH( pOH=-lgc(OH-) )与pH的变化关系如图所示,则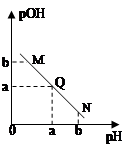
| A.N点所示溶液中c(H+) < c(OH-) |
| B.M点所示溶液导电能力强于Q点 |
| C.M点水的电离程度大于N点 |
| D.Q点消耗NaOH溶液的体积等于醋酸溶液的体积 |
A
解析试题分析:向醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液的氢离子浓度逐渐减小,pOH减小。所以Q点溶液呈中性,M点溶液呈酸性,N点呈碱性。所以,A正确;B、Q点溶液强电解质溶液,M点溶液为弱酸,N点碱过量,所以导电能力N>Q>M;C、M点c(H+) = N点c(OH-),水的电离程度相同;D、Q点溶液呈中性,酸稍过量。
考点:考查水溶液中的离子平衡。

练习册系列答案
相关题目
常温时,下列各溶液中有关粒子浓度的说法正确的是( )
| A.pH=5的NaHSO3溶液:c(HSO3-) > c(SO32-)> c(H2SO3) |
| B.pH=3的盐酸跟pH=11的氨水等体积混合: c(H+)>c(OH-) |
| C.pH<7的CH3COONa和CH3COOH的混合溶液 c(Na+)> c(CH3COO-)> c(H+)>c(OH-) |
| D.pH=12的NaOH溶液中:c(OH-)水电离=1.0×10-12 mol/L |
下列物质能促进水的电离的是
| A.小苏打 | B.醋酸 | C.乙醇 | D.氯化钠 |
在温度相同、浓度相同的条件下,下列六种物质的水溶液的pH由小到大的排列顺序如图所示。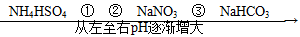
图中①②③可能是( )
| A.NH4NO3、(NH4)2SO4、CH3COONa |
| B.(NH4)2SO4、NH4Cl、C6H5ONa |
| C.(NH4)2SO4、NH4NO3、Na2CO3 |
| D.(NH4)2SO4、NH4NO3、CH3COONa |
50 ℃时,下列各溶液中,离子的物质的量浓度关系正确的是 ( )。
| A.pH=4的醋酸中:c(H+)=4.0 mol·L-1 |
| B.饱和小苏打溶液中:c(Na+)=c(HCO3—) |
| C.饱和食盐水中:c(Na+)+c(H+)=c(Cl-)+c(OH-) |
| D.pH=12的纯碱溶液中:c(OH-)=1.0×10-2 mol·L-1 |
欲同时对农作物施用含N、P、K三种元素的化肥,现有:①K2CO3、②KCl、③Ca(H2PO4)2、④(NH4)2SO4、⑤氨水,最适合的组合是( )。
| A.①②③ | B.②③④ | C.①③⑤ | D.②③⑤ |
硼酸(H3BO3)溶液中存在如下反应:H3BO3(aq)+H2O(l) [B(OH)4]-(aq)+H+(aq)。下列说法正确的是( )
[B(OH)4]-(aq)+H+(aq)。下列说法正确的是( )
| 化学式 | 电离常数(298 K) |
| H3BO3 | K=5.7×10-10 |
| H2CO3 | K1=4.4×10-7 K2=4.7×10-11 |
| CH3COOH | K=1.75×10-5 |
A.将一滴碳酸钠溶液滴入硼酸溶液中一定能观察到有气泡产生
B.将一滴醋酸溶液滴入碳酸钠溶液中一定能观察到有气泡产生
C.等物质的量浓度的碳酸溶液和硼酸溶液比较,pH:前者>后者
D.等物质的量浓度的碳酸钠溶液和醋酸钠溶液比较,pH:前者>后者
常温下,向20.00 mL 0.100 mol·L-1 CH3COONa溶液中逐滴加入0.100 0 mol·L-1盐酸,溶液的pH与所加盐酸体积的关系如下图所示(不考虑挥发)。下列说法正确的是( )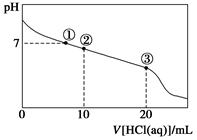
| A.点①所示溶液中:c(CH3COOH)=c(Cl-)>c(OH-)=c(H+) |
| B.点②所示溶液中:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH) |
| C.点③所示溶液中:c(CH3COOH)>c(Na+)>c(H+)>c(CH3COO-) |
| D.整个过程中可能出现:c(H+)+c(Na+)=c(CH3COOH)+c(CH3COO-) |
