题目内容
13.常温下,下列各组粒子在指定溶液中一定能大量共存的是( )| A. | FeCl3溶液中:K+、C6H5OH、Br-、NO3- | |
| B. | 在氨水溶液中 Al3+、NO3-、Cl-、Ag+ | |
| C. | 某透明澄清的溶液中:NH4+、Fe3+、NO3-、Cl- | |
| D. | 能使甲基橙显红色的溶液:K+、Cr2O72-、CH3CH2OH、SO42- |
分析 A.与Fe3+反应的离子不能大量共存;
B.氨水溶液呈碱性,且可与Ag+发生络合反应;
C.离子之间不发生任何反应;
D.能使甲基橙显红色的溶液呈酸性.
解答 解:A.C6H5OH与Fe3+反应,不能大量共存,故A错误;
B.氨水溶液呈碱性,Al3+不能大量共存,且氨水可与Ag+发生络合反应,故B错误;
C.离子之间不发生任何反应,可大量共存,故C正确;
D.能使甲基橙显红色的溶液呈酸性,酸性条件下Cr2O72-、CH3CH2OH发生氧化还原反应,故D错误.
故选C.
点评 本题考查离子的共存问题,为高频考点,侧重学生元素化合物知识的综合理解和运用的考查,明确信息来判断溶液的酸碱性是解答本题的关键,熟悉离子之间的反应即可解答,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.在3个2L的密闭容器中,在相同的温度下、使用相同的催化剂分别进行反应:3H2(g)+N2(g)$?_{催化剂}^{高温、高压}$2NH3(g).按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:下列说法不正确的是( )
| 容器 | 甲 | 乙 | 丙 |
| 反应物的投入量 | 3molH2、2molN2 | 6molH2、4molN2 | 2molNH3 |
| 达到平衡的时间/min | 5 | 8 | |
| 平衡时N2的浓度/mol•L-1 | c1 | 1.5 | |
| NH3的体积分数 | φ1 | φ2 | |
| 混合气体的密度/g•L-1 | ρ1 | ρ2 |
| A. | 容器乙中反应从开始到达平衡的反应速率为v(H2)=0.3mol•L-1•min-1 | |
| B. | 在该温度下甲容器中反应的平衡常数K=$\frac{(2-2{c}_{1})^{2}}{{c}_{1}•(3{c}_{1}-1.5)}$ | |
| C. | 2c1<1.5 | |
| D. | 2ρ1=ρ2 |
4.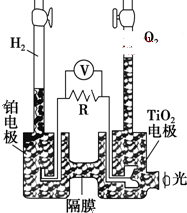 TiO2在光照射下可使水分解:2H2O$\frac{\underline{\;TiO_{2}\;}}{光}$2H2↑+O2↑,该过程类似植物的光合作用.下图是光照射下TiO2分解水的装置示意图.下列叙述正确的是( )
TiO2在光照射下可使水分解:2H2O$\frac{\underline{\;TiO_{2}\;}}{光}$2H2↑+O2↑,该过程类似植物的光合作用.下图是光照射下TiO2分解水的装置示意图.下列叙述正确的是( )
 TiO2在光照射下可使水分解:2H2O$\frac{\underline{\;TiO_{2}\;}}{光}$2H2↑+O2↑,该过程类似植物的光合作用.下图是光照射下TiO2分解水的装置示意图.下列叙述正确的是( )
TiO2在光照射下可使水分解:2H2O$\frac{\underline{\;TiO_{2}\;}}{光}$2H2↑+O2↑,该过程类似植物的光合作用.下图是光照射下TiO2分解水的装置示意图.下列叙述正确的是( )| A. | TiO2电极上发生的反应为:2H++2e-═H2↑ | |
| B. | 该装置工作时,TiO2电极附近溶液的pH变大 | |
| C. | 该装置工作时,电流由TiO2电极经R流向铂电极 | |
| D. | 该装置可以将光能转化为电能,同时也能将其转化为化学能 |
1.下列各组中属于同位素关系的是( )
| A. | H2与D2 | B. | T2O与H2O | ||
| C. | ${\;}_{19}^{40}$K与${\;}_{19}^{39}$K | D. | 金刚石与石墨 |
5.某同学用量筒量取液体时,将量筒放平稳,倒入液体,面对刻度线,第一次仰视凹液面最低处,读数为29ml;到出部分液体后,又俯视凹液面最低处,读数为11ml,该同学倒出的液体体积是( )
| A. | 18ml | B. | 大于18ml | C. | 小于18ml | D. | 无法判断 |
3.常温时,0.01mol•L-1某一元弱酸的电离常数Ka=10-6,则下列说法正确的是( )
| A. | 上述弱酸溶液的pH=4 | |
| B. | 加入NaOH溶液后,弱酸的电离平衡向右移动,K值增大 | |
| C. | 加入等体积0.01 mol•L-1 NaOH溶液后,所得溶液的pH=7 | |
| D. | 加入等体积0.01 mol•L-1 NaOH溶液后,所得溶液的pH<7 |
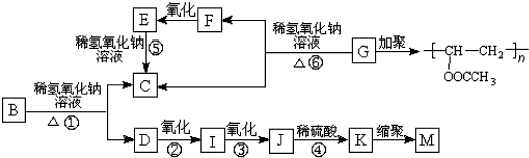
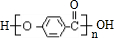 .
.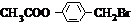 +3NaOH$→_{△}^{水}$CH3COONa+
+3NaOH$→_{△}^{水}$CH3COONa+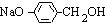 +NaBr+H2O,
+NaBr+H2O,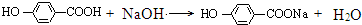 .
.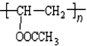 在氢氧化钠溶液中加热:
在氢氧化钠溶液中加热: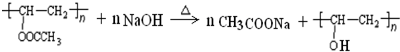 .
.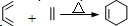
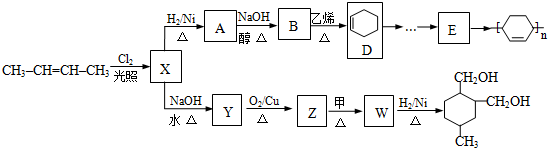
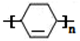
 ;Z→W
;Z→W .
.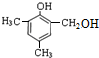 等.
等.