题目内容
某研究性学习小组为了制取氨气和探究氨气的有关性质,进行了下列实验.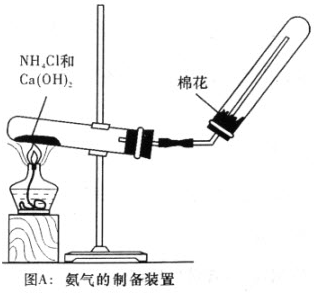
(1)根据图A氨气的制备装置制取氨气,试回答:收集氨气的方法是
(2)甲、乙两组同学用干燥的圆底烧瓶各收集一瓶氨气,根据图B喷泉实验的装置进行实验,都观察到美丽的红色喷泉.
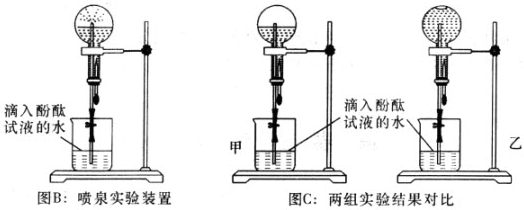
根据实验现象说明氨气具有的性质是
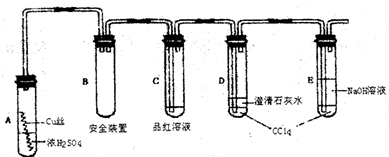
(3)甲、乙两组同学完成喷泉实验后,圆底烧瓶中所得溶液如图C所示.请通过分析确认:甲组同学所得氨水的物质的量浓度
分析:(1)根据氨气的溶解性及密度确定收集方法;氨气有刺激性气味,能污染大气;
(2)无色酚酞试液遇碱变红色,极易溶于水的气体能形成喷泉;
(3)氨气极易溶于水,喷入烧瓶中液体的体积与消耗的氨气成正比;
(2)无色酚酞试液遇碱变红色,极易溶于水的气体能形成喷泉;
(3)氨气极易溶于水,喷入烧瓶中液体的体积与消耗的氨气成正比;
解答:解:(1)氨气极易溶于水,所以不能采用排水法收集氨气,氨气的密度小于空气且常温下和氧气不反应,根据图象知,氨气采用向下排空气法收集;
氨气有刺激性气味,能污染大气,为防止管内气体与空气对流,减少氨气对大气的污染,便于收集纯的氨气,用棉花塞在试管口,
故答案为:向下排空气法;防止管内气体与空气对流,减少氨气对大气的污染,便于收集纯的氨气;
(2)无色酚酞遇碱变红色,根据图2喷泉实验的装置进行实验,都观察到美丽的红色喷泉,则氨气的水溶液呈碱性,氨气极易溶于水而形成压强差,导致形成喷泉,
故答案为:极易溶于水和溶于水后溶液呈碱性;
(3)氨气极易溶于水,喷入烧瓶中液体的体积与消耗的氨气成正比,因此甲组同学所得氨水的物质的量浓度等于乙组同学所得氨水的物质的量浓度,
故答案为:等于.
氨气有刺激性气味,能污染大气,为防止管内气体与空气对流,减少氨气对大气的污染,便于收集纯的氨气,用棉花塞在试管口,
故答案为:向下排空气法;防止管内气体与空气对流,减少氨气对大气的污染,便于收集纯的氨气;
(2)无色酚酞遇碱变红色,根据图2喷泉实验的装置进行实验,都观察到美丽的红色喷泉,则氨气的水溶液呈碱性,氨气极易溶于水而形成压强差,导致形成喷泉,
故答案为:极易溶于水和溶于水后溶液呈碱性;
(3)氨气极易溶于水,喷入烧瓶中液体的体积与消耗的氨气成正比,因此甲组同学所得氨水的物质的量浓度等于乙组同学所得氨水的物质的量浓度,
故答案为:等于.
点评:本题考查了氨气的实验室制法、收集方法、氨气的性质等知识点,明确实验原理是解本题关键,根据氨气的溶解性及密度确定收集方法,知道形成喷泉的条件:只要气体极易溶于该溶液就能形成喷泉,题目难度中等.

练习册系列答案
相关题目
某研究性学习小组为了探索镁粉与FeCl3溶液的反应机理,做了如下两组实验:
①将镁粉投入冷水中,未见明显现象;
②将镁粉投入FeCl3溶液中,观察到有气泡产生,溶液颜色逐渐变浅,同时逐渐产生红褐色沉淀.
则下列有关镁与FeCl3溶液反应的叙述中,正确的是( )
①将镁粉投入冷水中,未见明显现象;
②将镁粉投入FeCl3溶液中,观察到有气泡产生,溶液颜色逐渐变浅,同时逐渐产生红褐色沉淀.
则下列有关镁与FeCl3溶液反应的叙述中,正确的是( )
| A、镁只与FeCl3溶液中的Fe3+直接反应 | B、气泡是镁与FeCl3溶液中的水直接反应产生的 | C、红褐色沉淀是镁与水反应生成的Mg(OH)2与Fe3+反应所得 | D、汽泡是镁与FeCl3水解生成的盐酸反应产生的 |
 Cu(OH)2+2H+
Cu(OH)2+2H+ “白铁皮”具有较强的耐腐蚀性,是生产中常用的金属材料之一.镀锌层犹如铁皮的保护层,这层膜的厚度及均匀度也成了判断镀层质量的重要指标.某研究性学习小组为了测定镀锌铁皮的厚度,设计了下面的实验方案:
“白铁皮”具有较强的耐腐蚀性,是生产中常用的金属材料之一.镀锌层犹如铁皮的保护层,这层膜的厚度及均匀度也成了判断镀层质量的重要指标.某研究性学习小组为了测定镀锌铁皮的厚度,设计了下面的实验方案: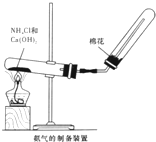 某研究性学习小组为了制取氨气和探究氨气的有关性质,进行了下列实验.
某研究性学习小组为了制取氨气和探究氨气的有关性质,进行了下列实验.