题目内容
【题目】4℃时500 mL水中溶解了112L氯化氢气体(在标准状况下测得)。下列关于所形成溶液的说法中正确的是( )
A.该溶液溶质的物质的量浓度为10mol·L1
B.该溶液溶质的质量分数约为26.7%
C.该溶液溶质的物质的量浓度因溶液的密度未知而无法求得
D.该溶液溶质的质量分数因溶液的密度未知而无法求得
【答案】BC
【解析】
4℃时水的密度为1g/ml,112L氯化氢气体的物质的量为![]() =5mol,据此分析判断。
=5mol,据此分析判断。
A. 由分析可知氯化氢气体的物质的量为5mol,溶质溶液的体积未知,因此无法计算溶液的浓度,A项错误;
B. 112L氯化氢气体的物质的量为5mol,溶质的质量为5mol×36.5mol/L=182.5g,溶液的质量为500g+182.5g=682.5g,因此溶质的质量分数为![]() ×100%=26.7%,B项正确;
×100%=26.7%,B项正确;
C. 溶液的密度未知,无法计算溶液的体积,因此不能计算物质的量浓度,C项正确;
D. 根据已知条件可计算溶质和溶液的质量,根据公式可以计算质量分数,D项错误;
答案选BC。

练习册系列答案
相关题目
【题目】根据下列实验和现象,所得实验结论正确的是( )
选项 | 实验 | 现象 | 实验结论 |
A | 向某溶液中先滴加适量稀硝酸,再滴加少量BaCl2溶液 | 出现白色沉淀 | 原溶液中含有SO42-、SO32-、HSO3-中的一种或几种 |
B | 将纯碱和硫酸反应生成的气体,通入一定浓度的Na2SiO3溶液中 | 出现白色胶状沉淀 | 酸性:H2SO4>H2CO3>H2SiO3 |
C |
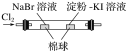
| 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性:Cl2>Br2>I2 |
D |
| 试管a出现白色沉淀,试管b出现黄色沉淀 | 溶度积:Ksp(AgCl)>Ksp(AgI) |
A.AB.BC.CD.D