题目内容
【题目】某小组欲探究反应2Fe2++I2![]() 2Fe3++2I,完成如下实验:
2Fe3++2I,完成如下实验:
资料:AgI是黄色固体,不溶于稀硝酸。新制的AgI见光会少量分解。
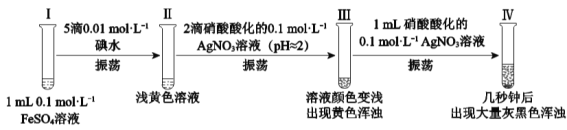
(1)Ⅰ、Ⅱ均未检出Fe3+,检验Ⅱ中有无Fe3+的实验操作及现象是:取少量Ⅱ中溶液,___。
(2)Ⅲ中的黄色浑浊是__。
(3)经检验,Ⅱ→Ⅲ的过程中产生了Fe3+。
①对Fe3+产生的原因做出如下假设:
假设a:空气中存在O2,由于___(用离子方程式表示),可产生Fe3+;
假设b:酸性溶液中NO3具有氧化性,可产生Fe3+;
假设c:___;
假设d:该条件下,I2溶液可将Fe2+氧化为Fe3+。
②通过实验进一步证实a、b、c不是产生Fe3+的主要原因,假设d成立。Ⅱ→Ⅲ的过程中I2溶液氧化Fe2+的原因是___。
(4)经检验,Ⅳ中灰黑色浑浊中含有AgI和Ag。
①验证灰黑色浑浊含有Ag的实验操作及现象是:取洗净后的灰黑色固体,___。
②为探究Ⅲ→Ⅳ出现灰黑色浑浊的原因,完成了实验1和实验2。
实验1:向1mL0.1 mol·L1 FeSO4溶液中加入1mL0.1mol·L1AgNO3溶液,开始时,溶液无明显变化。几分钟后,出现大量灰黑色浑浊。反应过程中温度几乎无变化。测定溶液中Ag+浓度随反应时间的变化如图。

实验2:实验开始时,先向试管中加入几滴Fe2(SO4)3溶液,重复实验1,实验结果与实验1相同。
ⅰ.实验1中发生反应的离子方程式是___。
ⅱ.Ⅳ中迅速出现灰黑色浑浊的可能的原因是___。
【答案】滴加几滴KSCN溶液,溶液不变红 AgI 4Fe2++O2+4H+=4Fe3++2H2O 溶液中Ag+具有氧化性,可产生Fe3+ Ag+与I生成了AgI沉淀,降低了I的浓度,使平衡2Fe2++I2![]() 2Fe3++2I正向移动,使I2氧化了Fe2+ 加入足量稀硝酸,振荡,固体部分溶解,产生无色气泡,遇空气变红棕色。静置,取上层清液加入稀盐酸,有白色沉淀生成 Fe2++Ag+=Fe3++Ag AgI分解产生的Ag催化了Fe2+与Ag+的反应
2Fe3++2I正向移动,使I2氧化了Fe2+ 加入足量稀硝酸,振荡,固体部分溶解,产生无色气泡,遇空气变红棕色。静置,取上层清液加入稀盐酸,有白色沉淀生成 Fe2++Ag+=Fe3++Ag AgI分解产生的Ag催化了Fe2+与Ag+的反应
【解析】
(1)、铁离子遇到KSCN溶液变红色;
(2)、AgI是黄色固体,不溶于稀硝酸;
(3)①、亚铁离子被氧气氧化生成铁离子;
②、Ag+与I生成了AgI沉淀,降低了I的浓度,使平衡2Fe2++I2=2 Fe3++2I-正向移动;
(4)①、验证灰黑色浑浊含有Ag的实验操作及现象是加入硝酸溶解后生成一氧化氮气体遇到空气变红棕色,溶液中加入盐酸生成白色沉淀;
②i向1 mL 0.1 mol/LFeSO4溶液中加入1 mL0.1 mol/LAgNO3溶液,开始时,溶液无明显变化。几分钟后,出现大量灰黑色浑浊,说明银离子氧化亚铁离子生成铁离子,银离子如氧化亚铁离子,则发生Ag++Fe2+=Ag+Fe3+;
ii经检验,IV中灰黑色浑浊中含有AgI和Ag,ii.IV中迅速出现灰黑色浑浊的可能的原因是快速发生反应Ag++Fe2+=Ag+Fe3+。
(1)、检验II中无Fe3+ 的实验操作及现象是:取少量II中溶液,滴加几滴KSCN溶液,溶液不变红,故答案为:滴加几滴KSCN溶液,溶液不变红;
(2)、分析可知,反应I中的黄色浑浊是AgI ,故答案为:AgI ;
(3)①、空气中存在O2,由于发生反应4Fe2++O2+4H+=4Fe3++2H2O,可产生Fe3+,溶液中Ag+具有氧化性,可产生Fe3+,酸性溶液中NO3-具有氧化性,可产生Fe3+,该条件下,I2溶液可将Fe2+氧化为Fe3+,故答案为: 4Fe2++O2+4H+=4Fe3++2H2O;溶液中Ag+具有氧化性,可产生Fe3+;
②、通过实验进一-步证实a、b、c不是产生Fe3+的主要原因,假设d成立,Ⅱ→Ⅲ的过程中I2溶液氧化Fe2+的原因是: Ag+与I-生成了AgI沉淀,降低了I-的浓度,使平衡2Fe2++I2=2 Fe3++2I-正向移动,使I2氧化了Fe2+,故答案为:Ag+与I生成了AgI沉淀,降低了I的浓度,使平衡2Fe2++I2![]() 2Fe3++2I正向移动,使I2氧化了Fe2+ ;
2Fe3++2I正向移动,使I2氧化了Fe2+ ;
(4)①验证灰黑色浑浊含有Ag的实验操作及现象是:取洗净后的灰黑色固体,加入足量稀硝酸,振荡,固体部分溶解,产生无色气泡,遇空气变红棕色。静置,取上层清液加入稀盐酸,有白色沉淀生成。
故答案为:加入足量稀硝酸,振荡,固体部分溶解,产生无色气泡,遇空气变红棕色。静置,取上层清液加入稀盐酸,有白色沉淀生成;
②i、实验1中发生反应的离子方程式是:Fe2++Ag+=Fe3++Ag,
故答案为:Fe2++Ag+=Fe3++Ag;
ii、iiIV中迅速出现灰黑色浑浊的可能的原因是:AgI分解产生的Ag催化了Fe2+与Ag+的反应。
故答案为:AgI分解产生的Ag催化了Fe2+与Ag+的反应;