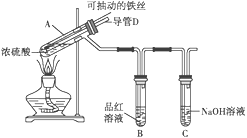
题目内容
【题目】下图是2SO2(g) + O2(g) = 2SO3(g)反应过程中的能量变化, 已知1mol SO2(g)完全氧化为1mol SO3的ΔH= —99kJ·mol-1,请回答下列问题:
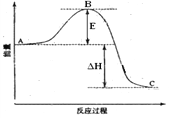
(1)图中A、C分别表的物质是__________________、________________,E的大小对该反应的焓变有无影响?___________(填“有”或“无”)(该反应通常用V2O5作催化剂,加V2O5会使图中B点降低。);
(2)图中△H = _____________kJ·mol-1;
(3)已知:S(s) + O2(g) = SO2(g) ΔH=-296 kJ·mol-1,计算由3 mol S(s)与氧气反应生成3 molSO3(g)的△H = ______________。
【答案】 SO2(g)与O2(g) SO3(g) 无 -198kJ/mol -1185kJ/mol
【解析】(1)因图中A、C分别表示反应物总能量、生成物总能量,故A表示的物质是SO2(g)与O2(g), C表示的物质是SO3(g);E为活化能,反应热可表示为A、C活化能的大小之差,活化能的大小与焓变无关,加入催化剂,活化能减小,反应反应热不变; (2)因1mol SO2(g)氧化为1mol SO3的△H=-99kJmol-1,所以2molSO2(g)氧化为2molSO3(g)的△H=-198kJmol-1,则2SO2(g) + O2(g) = 2SO3(g) △H=-198kJmol-1;(3)已知:①S(s) + O2(g) = SO2(g) ΔH1=-296 kJ·mol-1,②2SO2(g) + O2(g) = 2SO3(g) △H2=-198kJmol-1;根据盖斯定律,由①×3+②×![]() 得反应,3S(s) +
得反应,3S(s) + ![]() O2(g) = 3SO3(g) ΔH=ΔH1×3+△H2×
O2(g) = 3SO3(g) ΔH=ΔH1×3+△H2×![]() =-296 kJ·mol-1×3+(-198kJmol-1)×
=-296 kJ·mol-1×3+(-198kJmol-1)×![]() =-1185kJ/mol。
=-1185kJ/mol。