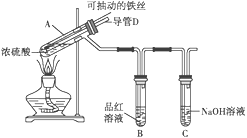
题目内容
【题目】如图是周期表中原子序数小于20的某些元素的单质的沸点与原子序数的关系,图中的原子序数是连续的. 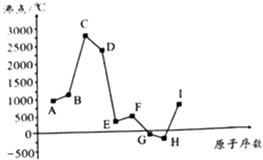
试根据图,回答下列问题:
(1)E元素在元素周期表中的位置是 .
(2)上述元素所形成的气态氢化物中最稳定的是(写化学式).
(3)上述元素中,最容易形成离子键的两种元素所形成的化合物是(写电子式).
(4)A和I两种元素相比,金属性较强的是(写元素符号),请你列举事实加以说明 .
(5)B和C的单质、A的最高价氧化物对应的水化物的水溶液三者可形成原电池,该原电池负极的电极反应式为 .
【答案】
(1)第三周期VA族
(2)HCl
(3)![]()
(4)K;钾与水反应比钠剧烈
(5)A1+4OH﹣﹣3e﹣=AlO2﹣+2H2O
【解析】解:图是周期表中原子序数小于20的9种元素单质的沸点与原子序数的关系,图中原子序数是连续的,G、H的沸点小于0℃,其它都大于250℃,且沸点G>H,则G为Cl、H为Ar,可推知A为Na、B为Mg、C为Al、D为Si、E为P、F为S、I为K.
(1.)组成E的元素为P,在周期表中的位置是:第三周期VA族,所以答案是:第三周期VA族;
(2.)组成A﹣I的元素中,Cl元素非金属性最强,氢化物最稳定的是HCl,所以答案是:HCl;
(3.)上述元素中,最容易形成离子键的两种元素所形成的化合物是KCl,其电子式为 ![]() ,所以答案是:
,所以答案是: ![]() ;
;
(4.)A和I两种元素相比,金属性较强的是K,钾与水反应比钠剧烈(或KOH的碱性强于NaOH等)可以说明K的金属性更强,所以答案是:K;钾与水反应比钠剧烈;
(5.)Mg和Al的单质、NaOH水溶液三者可形成原电池,Al与氢氧化钠溶液反应生成偏铝酸钠与氢气,Al为负极,负极的电极反应式为:A1+4OH﹣﹣3e﹣=AlO2﹣+2H2O,所以答案是:A1+4OH﹣﹣3e﹣=AlO2﹣+2H2O.