题目内容
【题目】实验室用硫酸铝酸性溶液制备可溶性的碱式硫酸铝[Ala(SO4)b(OH)c],并用它对烟气进行脱硫处理的过程如图1: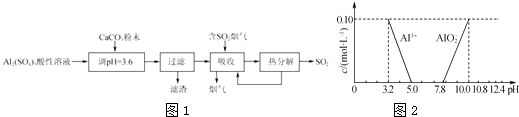
(1)加CaCO3调节溶液的pH至3.6,其目的是中和溶液中的酸,并使Al2(SO4)3转化为Ala(SO4)b(OH)c . 过滤时所用的玻璃仪器有、和烧杯,滤渣的主要成分为(填化学式).
(2)上述流程中经完全热分解放出的SO2量总是小于吸收的SO2量,其主要原因是;与吸收SO2前的溶液相比,热分解后循环利用的溶液的pH将(填“增大”“减小”或“不变”).
(3)Ala(SO4)b(OH)c中a、b、c的代数关系式为 .
(4)已知在常温下溶液中Al3+、AlO2﹣的浓度与溶液pH的关系如图2所示.为确定碱式硫酸铝的组成,进行如下实验:
①取2.18g碱式硫酸铝样品在空气中灼烧至恒重,样品质量减少了0.36g.
②另取2.18g碱式硫酸铝溶于水,调节溶液的pH到5.0~7.8.
③将②产生的沉淀过滤、洗涤、灼烧至恒重,称量剩余固体为1.02g.
请计算样品中Al3+和SO42﹣的物质的量之比(写出计算过程).
【答案】
(1)漏斗,玻璃棒,CaSO4
(2)溶液中的部分SO32﹣ 被氧化成SO42﹣,减小
(3)3a=2b+c
(4)n(Al3+):n(SO42﹣)=0.02 mol:0.01mol=2:1
【解析】解:根据流程可知,Al2(SO4)3溶液中加入CaCO3调节溶液的pH至3.6,使Al2(SO4)3转化为CaSO4沉淀,过滤得滤渣为CaSO4,滤液中含有铝离子、硫酸根离子等,吸收含有二氧化硫的烟气,在溶液中生成亚硫酸根离子,部分亚硫根离子会被空气氧化成硫酸,将溶液再加热亚硫酸盐分解生成二氧化硫,所得溶液循环利用再用来吸收烟气,
(1)过滤时所用的玻璃仪器有漏斗、玻璃棒、烧杯,通过以上分析知,滤渣的成分是CaSO4;
(2)溶液吸收二氧化硫生成SO32﹣,在溶液中SO32﹣易被氧化生成SO42﹣,所以上述流程中经完全热分解放出的SO2量总是小于吸收的SO2量;溶液中SO32﹣属于弱酸根离子被氧气氧化为转化为SO42﹣,SO42﹣为强酸根离子,则溶液酸性增强,pH减小;
(3)根据化合物中化合价代数和为零可知abc的关系为3a=2b+c;
(4)由步骤①可知n(H2O)=0.36 g/18 gmol﹣1=0.02 mol,所以n(OH﹣)=0.02 mol×2=0.04 mol,
由③可知1.02 g为Al2O3,则n(Al2O3)=1.02 g/102 gmol﹣1=0.01 mol,所以样品中n(Al3+)=0.02 mol 根据电荷守恒可知,样品中n(SO42﹣)=(0.02 mol×3﹣0.04 mol)/2=0.01 mol,所以n(Al3+):n(SO42﹣)=0.02 mol:0.01mol=2:1,
答:样品中Al3+和SO42﹣的物质的量之比为2:1.
故答案为:(1)漏斗、玻璃棒;CaSO4;(2)溶液中的部分SO32﹣ 被氧化成SO42﹣;减小;(3)3a=2b+c;(4)2:1
(1)过滤主要用于固液混合物的分离,所需仪器为铁架台、玻璃棒、烧杯、漏斗;
(2)SO2易溶于水形成H2SO3,而H2SO3易被空气中的氧气氧化成H2SO4;
(3)根据化合物中化合价代数和为0确定三者之间的关系;
(4)①样品减少的质量为H2O的质量;
②产生的沉淀为Al(OH)3;
③灼烧至恒重后,所得的固体为Al2O3。
明确各个数值所代表的物质,再结合相关元素守恒进行计算即可。

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案【题目】已知部分弱酸的电离平衡常数如下表所示:
弱酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
电离平衡常数Ka(25℃) | 1.75×10-5 | 2.98×10-8 | Ka1=4.3×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-7 Ka2=1.02×10-7 |
下列离子方程式正确的是
A. 少量的CO2通入NaClO溶液中:CO2+H2O+2C1O-==CO32-+2HClO
B. 少量的SO2通入Na2CO3溶液中:SO2+H2O+2CO32-==SO32-+2HCO3-
C. 少量的SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-==CaSO3↓+2HClO
D. 相同浓度的NaHCO3溶液与NaHSO3溶液等体积混合:H++HCO3-==CO2↑+H2O

