题目内容
9.下列电子式书写不正确的是( )| A. | HCl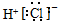 | B. | CaCl2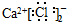 | C. | BaCl2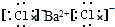 | D. | NaOH 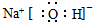 |
分析 根据原子的最外层电子数来分析电子式,并注意阴离子的电子式书写应用中括号和带电荷数,共价化合物不用中括号,将共用电子对用“-”表示即为结构式.
解答 解:A、HCl属于共价化合物,不存在离子键,分子中氢原子与氯原子之间形成1对共用电子对,HCl电子式为 ,故A错误;
,故A错误;
B、CaCl2是离子化合物,由钙离子与氯离子构成,电子式为 ,故答案为:
,故答案为: ,故B错误;
,故B错误;
C、氯化钡是离子化合物,书写电子式时要符合离子化合物的特点,电子式为: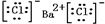 ,故C正确;
,故C正确;
D、氢氧化钠属于离子化合物,电子式中需要标出阴阳离子所带电荷,钠离子直接用离子符号表示,氢氧根离子需要标出最外层电子,氢氧化钠的电子式为: ,故D正确;故选AB.
,故D正确;故选AB.
点评 本题考查化学用语的使用,明确原子的最外层电子数及物质的类别、电子式的书写方法是解答本题的关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
19.下列分离或提纯物质的方法正确的是( )
| A. | 用溶解、过滤的方法提纯含有少量BaSO4的BaCO3 | |
| B. | 用过滤的方法除去NaCl溶液中含有的少量淀粉胶体 | |
| C. | 用渗析的方法精制Fe(OH)3胶体 | |
| D. | 用加热→蒸发的方法可以除去粗盐中的CaCl2、MgCl2等杂质 |
20.某结晶水合物的化学式为R•nH2O,其相对分子质量为M.25℃时,a g该晶体能够溶于b g水中形成V mL溶液.下列关系中不正确的是( )
| A. | 该溶液中溶剂与溶质的质量比为m(水):m(溶质)=( $\frac{18na}{M}$+b):(a-$\frac{18na}{M}$) | |
| B. | 该溶液的物质的量浓度为c=$\frac{1000a}{MV}$mol•L-1 | |
| C. | 该溶液中溶质的质量分数为ω=$\frac{100a(M-18n)}{a+b}$% | |
| D. | 该溶液的密度为ρ=$\frac{1000(a+b)}{V}$g•L-1 |
17.下列变化需要加入还原剂才能实现的是( )
| A. | Cu→Cu2+ | B. | Cl-→Cl2 | C. | MnO4-→Mn2+ | D. | NH3→NO |
4.下列过程中,不可逆的是( )
| A. | 蛋白质的盐析 | B. | 酯的酸催化水解 | C. | 蛋白质的变性 | D. | 氯化铁的水解 |
1.从海水中提取溴有如下反应:5NaBr+NaBrO3+3H2SO4═3Br2+3Na2SO4+3H2O,与该反应在氧化还原反应原理最相似的是( )
| A. | 2NaBr+Cl2═2NaCl+Br2 | |
| B. | AlCl3+3NaAlO2+6H2O═4Al(OH)3↓+3NaCl | |
| C. | 2H2S+SO2═2H2O+3S↓ | |
| D. | C+CO2$\frac{\underline{\;高温\;}}{\;}$2CO |
14.下列有关物质性质的说法错误的是( )
| A. | 热稳定性:HCl>HBr>HI | B. | 原子半径:Na>Mg>Al | ||
| C. | 还原性:PH3>H2S>HC1 | D. | 结合H+能力:CH3COO->HCO3->ClO- |
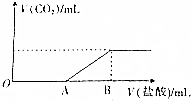 标准状况下,向100mL NaOH溶液中缓慢通入一定量的CO2气体,充分反应后,测得所得溶液M的pH>7(反应前后溶液的体积变化忽略不计),在溶液M中逐滴缓慢滴加1mol•L-1 的盐酸,所得气体的体积与所加盐酸的体积关系如图所示,已知图中B点的位置固定,V(B)=300mL,而A点可在横坐标中自由移动.
标准状况下,向100mL NaOH溶液中缓慢通入一定量的CO2气体,充分反应后,测得所得溶液M的pH>7(反应前后溶液的体积变化忽略不计),在溶液M中逐滴缓慢滴加1mol•L-1 的盐酸,所得气体的体积与所加盐酸的体积关系如图所示,已知图中B点的位置固定,V(B)=300mL,而A点可在横坐标中自由移动.