题目内容
1.为了使埋在地下的钢管不易生锈,设计了如下几种方案,将钢管:①用导线与铅板连接 ②用导线与锌板连接 ③用导线与碳棒连接 ④与直流电源负极连接 ⑤直流电源正极连接,其中可采取的方法是( )| A. | ①④ | B. | ②④ | C. | ②③ | D. | ①⑤ |
分析 采用化学方法防止金属被腐蚀时可以采用电化学方法,作原电池正极或电解池阴极的金属能防止被腐蚀,作原电池负极或电解池阳极的金属加速被腐蚀,据此分析解答.
解答 解:采用化学方法防止金属被腐蚀时可以采用电化学方法,作原电池正极或电解池阴极的金属能防止被腐蚀,作原电池负极或电解池阳极的金属加速被腐蚀,
①用导线与铅板连接,构成的原电池中Fe比Pb易失电子,所以Fe做负极而加速铁被腐蚀,故错误;
②用导线与锌板连接,构成的原电池中Zn比Fe易失电子,所以Fe作正极而被保护,故正确;
③用导线与碳棒连接,构成的原电池中Fe易失电子作负极,所以铁加速被腐蚀,故错误;
④与直流电源负极连接,构成的原电池中,Fe作阴极而被保护,故正确;
⑤直流电源正极连接,构成的原电池中Fe作阳极而加速被腐蚀,故错误;
故选B.
点评 本题考查金属的腐蚀与防护,明确原电池、电解池原理是解本题关键,防止金属被腐蚀可以采用物理方法或化学方法,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.对于可逆反应4NH3(g)+5O2(g)═4NO(g)+6H2O(g),下列叙述中正确的是( )
| A. | 达到化学平衡时v正(O2)=v逆(NO) | |
| B. | 若单位时间内生成xmolNO的同时生成 xmolNH3,则反应达到平衡状态 | |
| C. | 达化学平衡时,若增大容器体积,则正反应速率减小,逆反应速率增大 | |
| D. | 若反应发生在体积恒定的密闭容器中,当密度不变时,化学反应达到平衡状态 |
12.利用电解法可将含有Fe、Zn、Ag、Pt等杂质的粗铜提纯,下列叙述正确的是( )
| A. | 电解时可以精铜为阳极,以CuSO4溶液为电解液 | |
| B. | 电解时阴极发生还原反应 | |
| C. | 粗铜连接电源负极,其电极反应是Cu-2e-=Cu2+ | |
| D. | 电解结束后,电解质溶液的浓度保持不变 |
9.最新卫星测量结果显示,南、北极冰层融化加速,造成这种现象的主要原因是( )
| A. | 二氧化碳增多使太阳辐射到地球表面的能量增多 | |
| B. | 二氧化碳等气体能释放能量,使大气层的温度升高 | |
| C. | 氟氯烃等大量排放,破坏臭氧层引起的 | |
| D. | 二氧化碳、甲烷等温室气体产生温室效应,使大气温度升高,加速冰层融化 |
16.海水淡化大多采用的方法是( )
| A. | 蒸馏 | B. | 过滤 | C. | 萃取 | D. | 电渗析法 |
13.氨在化肥生产、贮氢及燃煤烟气脱硫脱硝等领域用途非常广泛.
(1)尿素[CO(NH2)2]与氰酸铵(NH4CNO)互为同分异构体;氰酸铵属于离子化合物(选填:“离子”或“共价”).
(2)液氨是一种贮氢材料,气态氨转变为液氨将释放能量(选填:“吸收”或“释放”).液氨可通过图1装置释放氢气,该过程中能量转化方式为电能转化为化学能.
(3)氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:6NO(g)+4NH3(g)?5N2(g)+6H2O(g).
①能说明该反应已达到平衡状态的标志是bc(不定项选择).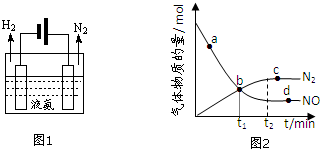
a.反应速率ν( NH3)=ν( N2)
b.容器内压强不再随时间而发生变化
c.容器内N2的物质的量分数不再随时间而发生变化
d.容器内n(NO):n(NH3):n(N2):n(H2O)=6:4:5:6
②某次实验中测得容器内NO及N2的物质的量随时间变化如图2所示,图中ν(正)与ν(逆)相等的点为cd(选填字母).
(4)已知:断开1mol共价键吸收的能量或形成1mol共价键释放的能量数据如表
则合成氨反应:N2(g)+3H2 (g)═2NH3(g)△H=-90.8kJ•mol-1
(5)工业上用氨水吸收硫酸工业尾气中的SO2,既可消除污染又可获得NH4HSO3等产品.若用1000kg 含NH3质量分数为17%的氨水吸收SO2且全部转化为NH4HSO3,不考虑其它成本,则可获得的利润为782元(参照下面的价格表).
(1)尿素[CO(NH2)2]与氰酸铵(NH4CNO)互为同分异构体;氰酸铵属于离子化合物(选填:“离子”或“共价”).
(2)液氨是一种贮氢材料,气态氨转变为液氨将释放能量(选填:“吸收”或“释放”).液氨可通过图1装置释放氢气,该过程中能量转化方式为电能转化为化学能.
(3)氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:6NO(g)+4NH3(g)?5N2(g)+6H2O(g).
①能说明该反应已达到平衡状态的标志是bc(不定项选择).

a.反应速率ν( NH3)=ν( N2)
b.容器内压强不再随时间而发生变化
c.容器内N2的物质的量分数不再随时间而发生变化
d.容器内n(NO):n(NH3):n(N2):n(H2O)=6:4:5:6
②某次实验中测得容器内NO及N2的物质的量随时间变化如图2所示,图中ν(正)与ν(逆)相等的点为cd(选填字母).
(4)已知:断开1mol共价键吸收的能量或形成1mol共价键释放的能量数据如表
| 共价键 | H-H | N-H | N≡N |
| 能量变化/kJ•mol-1 | 436 | 390.8 | 946 |
(5)工业上用氨水吸收硫酸工业尾气中的SO2,既可消除污染又可获得NH4HSO3等产品.若用1000kg 含NH3质量分数为17%的氨水吸收SO2且全部转化为NH4HSO3,不考虑其它成本,则可获得的利润为782元(参照下面的价格表).
| NH3质量分数17%的氨水 | 无水NH4HSO3 | |
| 价格(元/kg) | 1.0 | 1.8 |
11.将浓硫酸加入到盛有蔗糖的烧杯中,观察到下图所示现象,下列说法中不正确的是( )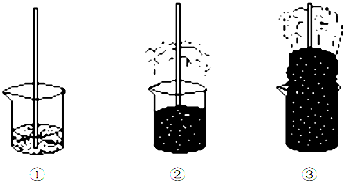

| A. | ②中现象说明浓硫酸具有很强的脱水性 | |
| B. | ③中现象说明浓硫酸具有很强的酸性 | |
| C. | ③中生成刺激性气味气体说明浓硫酸具有很强的氧化性 | |
| D. | ③中产生的气体通入品红溶液,可以观察到红色褪去 |
12.日常生活中遇到的很多问题都涉及到化学知识,下列有关做法在日常生活中可行的是( )
| A. | 医用酒精和工业酒精的主要成分相同,都可用于伤口消毒 | |
| B. | 可利用米汤检验含碘盐的真假 | |
| C. | 低血糖症状出现时,吃馒头要比喝葡萄糖水见效快 | |
| D. | 用食醋清洗热水瓶中的水垢 |
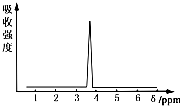 在有机物分子中,不同氢原子的核磁共振氢谱中给出的峰值(信号)也不同,根据峰值(信号)可以确定有机物分子中氢原子的种类和数目.
在有机物分子中,不同氢原子的核磁共振氢谱中给出的峰值(信号)也不同,根据峰值(信号)可以确定有机物分子中氢原子的种类和数目.