题目内容
1.对于反应2SO2(g)+O2(g)═2SO3(g),能增大逆反应速率的措施是( )| A. | 移去部分O2 | B. | 增大容器体积 | C. | 移去部分SO3 | D. | 升高体系温度 |
分析 该反应是一个反应前后气体体积减小的放热反应,要增大逆反应速率,可以通过改变温度、增大压强来改变,据此分析解答.
解答 解:A.移去部分氧气,反应物浓度减小,生成物浓度不变,则改变条件瞬间,逆反应速率不变,但随着反应进行,逆反应速率减小、正反应速率增大,正反应速率增大但需要改变条件之前反应速率,故A错误;
B.增大容器体积,压强减小,正逆反应速率都减小,故B错误;
C.移去部分三氧化硫,反应物浓度不变、生成物浓度减小,则改变条件瞬间,正反应速率不变、逆反应速率减小,故C错误;
D.升高温度,增大活化分子百分数,正逆反应速率都增大,故D正确;
故选D.
点评 本题考查化学反应速率影响因素,为高频考点,明确反应速率影响原理是解本题关键,改变压强实质上是通过改变浓度来影响反应速率的,题目难度不大.

练习册系列答案
相关题目
11.下列说法中,正确的是( )
| A. | 分液时,应先打开活塞放出下层液体,再关闭活塞倒出上层液体 | |
| B. | 将盛有体积比为2:1的NO和NO2混合气体的试管倒立在水中,溶液会充满试管 | |
| C. | 为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚内加热熔化 | |
| D. | 与水反应生成含氧酸的氧化物都是酸性氧化物 |
12.现有室温下的四种溶液,其pH如下表所示,下列有关叙述不正确的是( )
| ① | ② | ③ | ④ | |
| pH | 10 | 10 | 4 | 4 |
| 溶液 | 氨水 | NaOH溶液 | 醋酸 | 盐酸 |
| A. | ③④中分别加入适量醋酸钠晶体,两溶液pH均增大 | |
| B. | ②③两溶液等体积混合,所得溶液中:c(H+)>c(OH-) | |
| C. | 分别加水稀释10倍,溶液的pH:①>②>④>③ | |
| D. | V1L④和V2L①溶液混合后,若pH=7,则V1<V2 |
9.下列解释实验现象的反应方程式正确的是( )
| A. | 切开的金属Na暴露在空气中,光亮表面逐渐变暗:2Na+O2═Na2O2 | |
| B. | AlCl3溶液中加入过量稀氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | Na2O2在潮湿的空气中放置一段时间,变成白色粘稠物:2Na2O2+2H2O═4NaOH+O2↑ | |
| D. | 向NaHCO3溶液中加入足量Ba(OH)2溶液,出现白色沉淀:2HCO3-+Ba2++2OH-═BaCO3↓+CO32-+2H2O |
13.有机物分子中基团间的相互影响会导致化学性质的不同.下列叙述能说明侧链对苯环有影响的是( )
| A. | 苯酚能与3molH2加成得到环己醇 | |
| B. | 甲苯可以使酸性高锰酸钾溶液褪色 | |
| C. | 苯酚与浓溴水反应可得到2,4,6-三溴苯酚 | |
| D. | 苯酚能与NaOH溶液反应生成苯酚钠 |
10.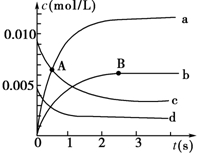 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
(1)A点处,v(正)大于v(逆),A点正反应速率大于B点正反应速率(用“大于”、“小于”或“等于”填空).
(2)如图中表示NO2的变化的曲线是b.用O2表示从0~2s内该反应的平均速率v=0.0015mol/(L•s).
(3)能说明该反应已经达到平衡状态的是bc.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内的密度保持不变
(4)能使该反应的反应速率增大的是bcd.
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂.
 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)如图中表示NO2的变化的曲线是b.用O2表示从0~2s内该反应的平均速率v=0.0015mol/(L•s).
(3)能说明该反应已经达到平衡状态的是bc.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内的密度保持不变
(4)能使该反应的反应速率增大的是bcd.
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂.


 .
.