题目内容
6.图是实验室制备氯气并进行相关实验的装置(夹持及加热仪器已省去).
(1)装有饱和食盐水的装置B的作用主要有两个:除去Cl2中的HCl;安全瓶;
(2)装置C中I、Ⅱ、Ⅲ依次放置湿润的有色布条、无水氯化钙、干燥的有色布条,该实验的目的是氯气是否具有漂白性.
(3)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱.当向D中缓缓通入少量氯气时,可以看到无色溶液逐渐变为黄色;打开活塞,将装置D中少量溶液加入装置E中,反应的化学方程式为Br2+2KI=I2 +2KBr.
(4)装置F中的作用是吸收剩余的氯气,反应的化学方程式为2NaOH+Cl2=NaCl+NaClO+H2O.
分析 (1)依据制备氯气用到的浓盐酸具有挥发性,可知制备的氯气中混有氯化氢杂质,通过B除去氯化氢杂质,结合装置中气体压强变化分析;
(2)干燥的氯气依次通过湿润的有色布条、无水氯化钙、干燥的有色布条,通过布条颜色变化判断氯气是否具有漂白性;
(3)当向D中缓缓通入少量氯气时,氯气和溴化钠反应生成溴单质,可以看到无色溶液逐渐变为黄色;说明氯气氧化性强于溴单质;打开活塞,将装置D中少量溶液加入装置E中,生成的溴单质和碘化钾反应生成碘单质;
(4)装置F中用足量的NaOH溶液吸收余氯反应的化学方程式是氯气和氢氧化钠反应生成氯化钠、次氯酸钠、水;
解答 解:(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,加热促进浓盐酸挥发,制备的氯气中含有氯化氢和水蒸气杂质,装置B中饱和食盐水的作用是除去Cl2中的HCl;装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,发生堵塞时B中的,压强增大,B中长颈漏斗中液面上升,形成水柱;
故答案为:除去Cl2中的HCl;安全瓶;
(2)C中I、Ⅱ、Ⅲ依次放入湿润的有色布条、无水氯化钙、干燥的有色布条,目的分别是检验湿润的氯气具有漂白性、干燥氯气、检验干燥的氯气不具有漂白性;
故答案为:氯气是否具有漂白性;
(3)D中是溴化钠,当向D中缓缓通入少量氯气时,氯气和溴化钠反应生成溴单质,可以看到无色溶液逐渐变为黄,所以现象为:溶液从无色变化为黄色;打开活塞,将装置D中含溴单质的少量溶液加入焓碘化钾和苯的装置E中,溴单质和碘化钾反应生成碘单质,化学方程式:Br2+2KI=I2 +2KBr;
故答案为:黄色;Br2+2KI=I2 +2KBr;
(4)装置F中用足量的NaOH溶液吸收剩余氯反应,化学方程式为:2NaOH+Cl2=NaCl+NaClO+H2O;
故答案为:吸收剩余氯反应;2NaOH+Cl2=NaCl+NaClO+H2O;
点评 本题考查了氯气的制备及性质的检验,熟悉制备原理和氯气的性质是解题关键,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 用醋酸除去水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O | |
| C. | 锌片插入硝酸银溶液中:Zn+Ag+=Zn2++Ag | |
| D. | 碳酸氢铵溶液与足量氢氧化钠溶液反应:NH4++OH-=NH3•H2O |
| A. | 蛋白质 | B. | 纤维素 | C. | 淀粉 | D. | 油脂 |
| A. | 取少量浑浊的天然水,加入适量明矾,天然水变得澄清透明 | |
| B. | 分别通过盛有品红溶液的洗气瓶可以鉴别SO2和CO2 | |
| C. | 保存硅酸钠溶液可以使用磨口玻璃塞、细口玻璃瓶 | |
| D. | 向Fe(OH)3胶体中逐滴加入过量的稀盐酸,先生成红褐色沉淀,最后沉淀又溶解 | |
| E. | 用镊子从煤油中夹取小块金属钠直接投入水中 |
| A. | 移去部分O2 | B. | 增大容器体积 | C. | 移去部分SO3 | D. | 升高体系温度 |
| A. | 用金属钠分别与同浓度苯酚和乙醇的水溶液反应,比较两者羟基氢(-OH)的活泼性 | |
| B. | 石墨作电极,电解Cu(NO3)2、AgNO3 的混合溶液,比较金属铜和银的金属活动性 | |
| C. | 分别测定CH4 和H2S 的沸点高低,比较硫和碳两种元素的非金属性强弱 | |
| D. | 用检验Na2CO3 和Na2SO3 水溶液酸碱性实验,比较碳和硫两元素非金属性的强弱 |
| C)°密度(20 | 熔点 | 沸点 | 熔解性 | |
| A | 0.713 7g•cm3- | C°-116.3 | C°34.5 | 不溶于水 |
| B | 0.789 3g•cm3- | C°-117.3 | C°78.5 | 与水以任意比混溶 |
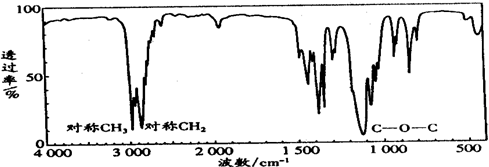
(1)要除去A、B混合物中的少量A,可采用A方法即可得到B.
A.蒸馏 B.重结晶 C.萃取 D.加水充分振荡,分液
(2)若B的分子式为C2H6O,核磁共振氢谱表明其分子中有三种不同化学环境的氢原子,强度之比为3:2:1.则B的结构简式为CH3CH2OH.
(3)若质谱图显示A的相对分子质量为74,红外光谱如图所示,则A的结构简式为CH3CH2OCH2CH3.
| A. | 1 mol青石棉能使1 mol稀硝酸被还原 | |
| B. | 青石棉中含有一定量的石英晶体 | |
| C. | 青石棉属于新型无机非金属材料 | |
| D. | 青石棉不属于硅酸盐原料 |
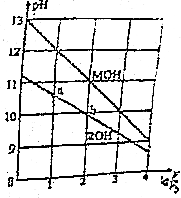 0.1mol/L体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随1gV/V0的变化如图所示,下列叙述错误的是( )
0.1mol/L体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随1gV/V0的变化如图所示,下列叙述错误的是( )| A. | ROH的电离方程式为ROH═R++OH- | |
| B. | ROH的电离程度:b点大于a点 | |
| C. | 等pH的ROH和MOH溶液,则MOH的浓度低 | |
| D. | 当1gV/V0=2时,若两溶液同时升高温度,则C(R+)增大,C(M+)不变 |