题目内容
11.下列说法中,正确的是( )| A. | 分液时,应先打开活塞放出下层液体,再关闭活塞倒出上层液体 | |
| B. | 将盛有体积比为2:1的NO和NO2混合气体的试管倒立在水中,溶液会充满试管 | |
| C. | 为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚内加热熔化 | |
| D. | 与水反应生成含氧酸的氧化物都是酸性氧化物 |
分析 A.分液时注意液体不能重新混合而污染,上层液体应从上口倒出;
B.依据方程式:4NO2+O2+2H2O=4HNO3、4NO+3O2+2H2O=4HNO3解答;
C.氢氧化钠可与二氧化硅反应;
D、氧化物和水反应生成含氧酸的氧化物不一定是酸性氧化物.
解答 解:A.分液时注意液体不能重新混合而污染,上层液体应从上口倒出,故A正确;
B.依据方程式:4NO2+O2+2H2O=4HNO3、4NO+3O2+2H2O=4HNO3,NO和NO2体积比为2:1混合,倒立在水中不能完全反应生成硝酸,溶液不会充满试管,故B错误;
C.瓷坩埚的主要成分是二氧化硅,加热条件下二氧化硅可与氢氧化钠反应生成硅酸钠,导致坩埚炸裂,故C错误;
D、氧化物和水反应生成含氧酸的氧化物不一定是酸性氧化物,如NO2和水反应生成硝酸和一氧化氮,NO2不是酸性氧化物,故D错误.
故选A.
点评 本题考查了物质的性质,熟悉氮的氧化物、二氧化硅、二氧化硫、次氯酸的性质,侧重考查学生对基础知识掌握熟练程度,题目难度不大,注意对基础知识的积累,注意总结常见漂白性物质及其漂白原理.

练习册系列答案
相关题目
1.下列关于物质的量浓度表述正确的是( )
| A. | 0.3 mol•L-1 Na2SO4溶液中含有Na+和SO${\;}_{4}^{2-}$总物质的量为0.9 mol | |
| B. | 50mL 1 mol•L-1的KCl溶液和100mL 0.5 mol•L-1MgCl2溶液中,Cl-的物质的量浓度相等 | |
| C. | 用1 L水吸收22.4 L氨气所得氨水的浓度是1 mol•L-1 | |
| D. | 10℃时0.35 mol•L-1的KCl饱和溶液100 mL,蒸发掉5 g水,再冷却到10℃时,它的物质的量浓度仍为0.35 mol•L-1 |
19.下列各物质中互为同系物的是( )
| A. | 甲醇、乙二醇 | B. | 正丁烷和异丁烷 | C. |  和 和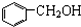 | D. |  和 和 |
6.NA代表阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 7.8g苯中含有碳碳双键数目为0.3NA | |
| B. | 1mol的羟基(-OH)所含电子的数目为9NA | |
| C. | 25℃时,pH=13的NaOH溶液中含有OH-的数目为0.1NA | |
| D. | 1.0L 1.0mo1•L-1的NaAlO2水溶液中含有的氧原子数为2NA |
16.下列离子方程式中正确的是( )
| A. | 用醋酸除去水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O | |
| C. | 锌片插入硝酸银溶液中:Zn+Ag+=Zn2++Ag | |
| D. | 碳酸氢铵溶液与足量氢氧化钠溶液反应:NH4++OH-=NH3•H2O |
20.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 标准状况下,22.4L酒精含有的分子数为 NA | |
| B. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.01 NA | |
| C. | 11.2 L H2所含的电子数为NA | |
| D. | 通常状况下,NA个CO2分子含有电子数为22 NA |
1.对于反应2SO2(g)+O2(g)═2SO3(g),能增大逆反应速率的措施是( )
| A. | 移去部分O2 | B. | 增大容器体积 | C. | 移去部分SO3 | D. | 升高体系温度 |
 某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案.装置如图:
某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案.装置如图: