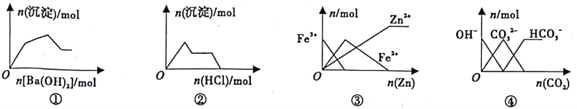
题目内容
【题目】某实验小组设计如下实验装置(图中夹持装置省略)测定制备的CaCO3粉末的纯度(样品中杂质不与酸反应,反应前装置中的CO2已全部排出)。下列说法错误的是( )
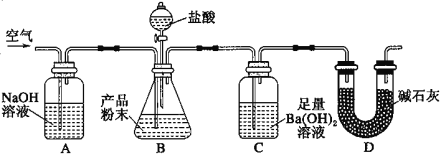
A.缓缓通入空气的作用是将反应结束后装置中残留的CO2全部鼓入到C装置中被吸收
B.A装置和D装置都是为了防止空气中的CO2气体进入C 装置而产生误差
C.若CaCO3样品的质量为x,从C 中取出的沉淀洗净干燥后的质量为y,则CaCO3的纯度为![]()
D.为了防止B 中盐酸挥发产生干扰,必须在B、C装置中间加一个装有饱和碳酸氢钠溶液的洗气瓶
【答案】D
【解析】
测定制备的CaCO3粉末的纯度,可加入盐酸,生成的二氧化碳用足量的氢氧化钡溶液吸收,根据生成的沉淀的质量确定二氧化碳的量,并以此测定碳酸钙的纯度,实验时将空气通过A中的氢氧化钠溶液,可除去空气中二氧化碳,且在反应后继续通入空气,以保证二氧化碳全部被吸收,D中碱石灰可防止空气中的二氧化碳进入C,防止结果偏大,据此分析解答。
A.由以上分析可知,缓缓通入空气的作用是将反应结束后装置中残留的CO2全部鼓入到C装置中被吸收,防止结果偏低,故A正确;
B.A装置和D装置都可与空气中的二氧化碳反应,防止空气中的CO2气体进入C装置而产生误差,故B正确;
C.若CaCO3样品的质量为x,从C中取出的沉淀洗净干燥后的质量为y,则n(BaCO3)=![]() ,则样品中的m(CaCO3)=
,则样品中的m(CaCO3)=![]() ×M(CaCO3),则CaCO3的纯度为
×M(CaCO3),则CaCO3的纯度为![]() ×100%,故C正确;
×100%,故C正确;
D.在B、C装置中间加一个装有饱和碳酸氢钠溶液的洗气瓶,盐酸与碳酸氢钠反应生成二氧化碳,导致结果偏高,因氢氧化钡过量,可以不除去HCl,不影响生成沉淀碳酸钡的质量,故D错误;
故选D。

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案【题目】如图是铁与水蒸气反应的实验装置。在硬质玻璃管中放入还原铁粉和石棉绒(石棉绒是耐高温材料,与水、铁不反应)的混合物,加热,并通入水蒸气,就可以完成高温下铁与水蒸气反应的实验。
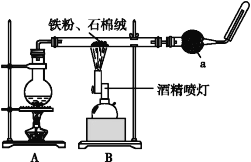
(1)该实验反应的反应方程式为:___。
(2)仪器a的名称是___。
(3)某同学为了研究一定时间内铁粉的转化率,设计了如下实验:准确称量一定质量的铁粉进行反应,测量反应后生成气体的体积,计算铁粉的转化率。
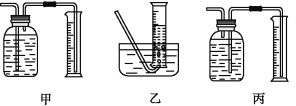
①该同学应该先点燃__(填“A”或“B”)处的酒精灯(或酒精喷灯),测量气体体积不可以选用上图中___(填“甲”“乙”或“丙”)装置。
②称取5.6g铁粉与适量石棉绒混合,然后加热反应一段时间。若测出的气体体积在标准状况下为0.896L,则铁粉的转化率为__。(转化率=![]() )
)
(4)将硬质玻璃管中反应后的固体混合物全部取出置于烧杯中,加入足量的盐酸溶解并过滤,为探究反应后溶液中可能的阳离子,小林同学进行如下实验,请你将下表补充完整:
步骤 | 现象 | 解释(用离子方程式表示) | 结论 |
Ⅰ.取样,滴加KSCN溶液 | 溶液不变红色(Fe3+与KSCN溶液反应显红色) | ①Fe3O4+8H+=Fe2++2Fe3++4H2O ②____ | Ⅲ.反应后的溶液中阳离子为___ |
Ⅱ.取样,滴加NaOH溶液 | 刚开始无明显现象,一段时间后先出现白色沉淀,迅速变为灰绿色,最终变为红褐色 | ①___ ②Fe2++2OH—=Fe(OH)2↓(白色) 4Fe(OH)2+2H2O+O2=4Fe(OH)3 |