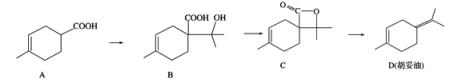
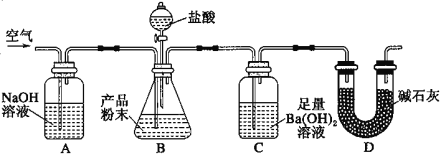
题目内容
【题目】X是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y的负一价离子的最外层电子数与次外层的相同。回答下列问题:
(1)单质X的晶体类型为___________,其中X原子的配位数为___________。
(2)元素Y基态原子的核外电子排布式为_____________,同周期元素中,第一电离能最大的是___________(写元素符号)。
(3)X与Y形成的一种化合物的立方晶胞如图所示。
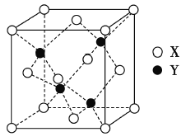
①该化合物的化学式为____________________,已知晶胞参数a=0.542nm,此晶体的密度为____________ g·cm-3。(写出计算式,不要求计算结果。阿伏加德罗常数为NA)
②该化合物难溶于水但易溶于氨水,其原因是________。
【答案】金属晶体 12 1s22s22p63s23p5 Ar CuCl ![]() Cu2+可与氨形成易溶于水的配位化合物(或配离子)
Cu2+可与氨形成易溶于水的配位化合物(或配离子)
【解析】
X是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子,原子核外电子数=2+8+18+1=29,则X为Cu;元素Y的负一价离子的最外层电子数与次外层的相同,原子只能有3个电子层,最外层电子数为7,则Y为Cl元素。
(1)铜是金属,属于金属晶体,晶体中金属阳离子与电子之间通过金属键结合在一起;铜晶体中原子为面心立方最密堆积;
(2)Y是Cl元素,Cl是17号元素,结合能量最低原理书写原子核外电子排布式;同一周期元素中稀有气体的第一电离能最大;
(3)①均摊法计算晶胞中Cu、Cl原子数目,确定化学式,计算晶胞中原子总质量,晶体密度![]() 计算;②根据物质容易形成配位化合物分析。
计算;②根据物质容易形成配位化合物分析。
根据上述推断可知X是Cu元素,Y是Cl元素。
(1)铜属于金属,金属阳离子与电子之间通过金属键结合在一起,晶体类型为金属晶体,铜晶体是面心立方最密堆积,铜原子的配位数是12;
(2)Cl元素是17号元素,根据构造原理可知基态Cl原子核外电子排布式为1s22s22p63s23p5,Cl位于第三周期,同一周期的元素的第一电离能随原子序数的增大而增大,所以稀有气体原子为稳定结构,其同周期元素中第一电离能最大的是Ar;
(3)①晶胞中含有铜原子个数为:8×![]() +6×
+6×![]() =4,Cl原子个数为4,Cu、Cl原子数目之比为1:1,则化学式为:CuCl,晶胞质量m(晶胞)=4×
=4,Cl原子个数为4,Cu、Cl原子数目之比为1:1,则化学式为:CuCl,晶胞质量m(晶胞)=4×![]() g,则晶体的密度ρ=
g,则晶体的密度ρ=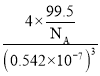 g/cm3=
g/cm3=![]() g/cm3;②Cu2+容易与氨水中的NH3形成络离子,因此容易溶解在氨水中。
g/cm3;②Cu2+容易与氨水中的NH3形成络离子,因此容易溶解在氨水中。

【题目】—定条件下,向密闭容器中充入一定量的气体X,发生反应3X(g)![]() Y(g)+xZ(g),一段时间后反应达到平衡。12min时,将容器体积压缩至原来的一半,一段时间后反应再次达到平衡。反应中各时刻X物质的浓度如下表所示。下列说法中不正确的是( )
Y(g)+xZ(g),一段时间后反应达到平衡。12min时,将容器体积压缩至原来的一半,一段时间后反应再次达到平衡。反应中各时刻X物质的浓度如下表所示。下列说法中不正确的是( )
反应时间(min) | 0 | 5 | 12 | 17 | 20 |
X的浓度(mol·L-1) | 1.0 | 0.4 | 0.4 | 0.7 | 0.7 |
A.x=1
B.5min时该反应处于化学平衡状态
C.从反应开始到18min时,X的转化率为30%
D.05min内,该反应的平均速率为v(X)=0.12mol·L-1·min-1