题目内容
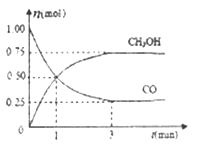
【题目】制备纯净、干燥的氯气,并试验它与金属的反应。每个虚线框表示一个单元装置,其中有错误的是
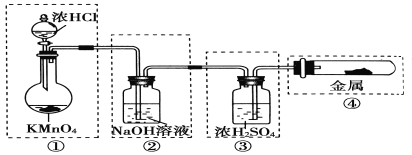
A. ①② B. ② C. ②③ D. ②③④
【答案】D
【解析】
KMnO4与浓盐酸常温下即可反应,①是正确的;制得的Cl2中含有HCl气体和水蒸气,显然不能用NaOH溶液来吸收HCl,因为它同时也吸收Cl2,②是错误的;在用浓H2SO4干燥Cl2时,应是“长管进、短管出”,③是错误的;Cl2与金属的反应,若用图示中的装置,应将导管伸入试管底部,金属也应置于试管底部,且试管口不应加橡胶塞,更好的方法是用两端开口的硬质玻璃管,在右端连接盛NaOH溶液的尾气吸收装置,因而④也是错误的。
点拨:本题考查实验室制备氯气,考查考生实验动手的能力。难度中等。

练习册系列答案
相关题目