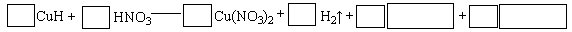题目内容
(1)含铬化合物有毒,对人畜危害很大。因此含铬废水必须进行处理才能排放。
已知: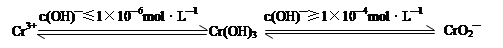
在含+6价铬的废水中加入一定量的硫酸和硫酸亚铁,使+6价铬还原成+3价铬;再调节溶液pH在6~8之间,使Fe3+和Cr3+转化为Fe(OH)3、Cr(OH)3沉淀而除去。
①写出Cr2O72—与FeSO4溶液在酸性条件下反应的离子方程式 。
②完成用离子方程式表示溶液pH不能超过10(即c(OH)—≥1×10—4mol·L—1)的原因为Cr(OH)3 + OH-= +2H2O。
(2)在硝酸工业生产吸收塔中,将硝酸生产中排出的尾气(体积分数:含0.5% NO、1.5% NO2)用纯碱溶液完全吸收,完成反应方程式:NO+3NO2+2Na2CO3=3NaNO2+NaNO3+2 ,该反应中能用纯碱代替氢氧化钠溶液发生反应的原因是利用了Na2CO3水解呈现的 性。
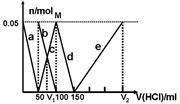
(3)一定浓度的HF和Al2(SO4)3混合液中,铝的各种微粒含量?随pH的分布曲线如图示。用NaOH使混合液的pH从5调整到7,完成有关反应的离子方程式为:
___________+3OH-=Al(OH)3↓+2F-;__________+3OH-=Al(OH)3↓+3F-。

已知:
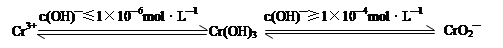
在含+6价铬的废水中加入一定量的硫酸和硫酸亚铁,使+6价铬还原成+3价铬;再调节溶液pH在6~8之间,使Fe3+和Cr3+转化为Fe(OH)3、Cr(OH)3沉淀而除去。
①写出Cr2O72—与FeSO4溶液在酸性条件下反应的离子方程式 。
②完成用离子方程式表示溶液pH不能超过10(即c(OH)—≥1×10—4mol·L—1)的原因为Cr(OH)3 + OH-= +2H2O。
(2)在硝酸工业生产吸收塔中,将硝酸生产中排出的尾气(体积分数:含0.5% NO、1.5% NO2)用纯碱溶液完全吸收,完成反应方程式:NO+3NO2+2Na2CO3=3NaNO2+NaNO3+2 ,该反应中能用纯碱代替氢氧化钠溶液发生反应的原因是利用了Na2CO3水解呈现的 性。
(3)一定浓度的HF和Al2(SO4)3混合液中,铝的各种微粒含量?随pH的分布曲线如图示。用NaOH使混合液的pH从5调整到7,完成有关反应的离子方程式为:
___________+3OH-=Al(OH)3↓+2F-;__________+3OH-=Al(OH)3↓+3F-。

(12分)(1)①Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O ②CrO2—
(2)CO2;碱 (3)AlF2+;AlF3
(2)CO2;碱 (3)AlF2+;AlF3
试题分析:(1)①Cr2O72—具有氧化性,能把硫酸亚铁氧化生成硫酸铁,所以Cr2O72—与FeSO4溶液在酸性条件下反应的离子方程式为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
②根据已知信息可知,溶液pH不能超过10时氢氧化铬会溶解在强碱中生成CrO2—,即反应的离子方程式为Cr(OH)3 +OH-=CrO2—+2H2O。
(2)根据原子守恒可知,另外一种生成物是CO2,所以反应的化学方程式为NO+3NO2+2Na2CO3=3NaNO2+NaNO3+2CO2。碳酸钠是强碱弱酸盐,CO32-水解溶液显碱性。
(3)根据图像可知,混合液的pH从5调整到7时,AlF2+和AlF3的浓度降低,这说明二者是参加反应,所以有关的离子方程式为AlF2++3OH-=Al(OH)3↓+2F-;AlF3+3OH-=Al(OH)3↓+3F-。

练习册系列答案
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案
相关题目
 回答以下问题:
回答以下问题: