题目内容
在2 L密闭容器内,800 ℃时反应2NO(g)+O2(g)  2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
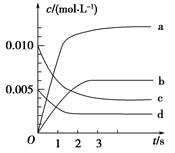
(1)下图表示NO2的变化的曲线是________。用O2表示从0~2 s内该反应的平均速率v=________。
(2)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(3)为使该反应的反应速率增大,下列措施正确的是________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)下图表示NO2的变化的曲线是________。用O2表示从0~2 s内该反应的平均速率v=________。

(2)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(3)为使该反应的反应速率增大,下列措施正确的是________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
(1)b 1.5×10-3 mol·(L·s)-1 (2)bc (3)bcd
(1)NO2的起始浓度为c(NO2)=0,2 s时c(NO2)可根据图表中n(NO)的变化量求解,c(NO2)=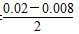 mol·L-1=0.006 mol·L-1,故答案选b。由图表可求0~2 s内v(NO)=
mol·L-1=0.006 mol·L-1,故答案选b。由图表可求0~2 s内v(NO)=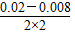 mol·(L·s)-1=0.003 mol·(L·s)-1,故v(O2)=1.5×10-3mol·(L·s)-1。
mol·(L·s)-1=0.003 mol·(L·s)-1,故v(O2)=1.5×10-3mol·(L·s)-1。
(2)a:在任意状态下,都存在v(NO2)=2v(O2)这样的速率关系,不能作为平衡状态的标志,故a错。
b:因该反应为气体体积不等的反应,故压强不变可作为平衡状态的标志。
c:由v逆(NO)=2v正(O2),可推出v逆(NO)=v正(NO),说明已达到平衡状态。
d:由于平衡体系中全是气体,容器体积固定,故任意状态下密度不变,故d错。
(3)及时分离出NO2气体,只能使平衡向正反应方向移动,不能增大反应速率,故a错;因该反应为放热反应,适当升高温度,虽使反应速率增大,但平衡向逆反应方向移动,故b错;增大O2的浓度既能增大反应速率,又能使平衡向正反应方向移动,故c正确;催化剂只能增大反应速率,不能影响化学平衡的移动,故d错。
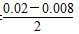 mol·L-1=0.006 mol·L-1,故答案选b。由图表可求0~2 s内v(NO)=
mol·L-1=0.006 mol·L-1,故答案选b。由图表可求0~2 s内v(NO)=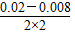 mol·(L·s)-1=0.003 mol·(L·s)-1,故v(O2)=1.5×10-3mol·(L·s)-1。
mol·(L·s)-1=0.003 mol·(L·s)-1,故v(O2)=1.5×10-3mol·(L·s)-1。(2)a:在任意状态下,都存在v(NO2)=2v(O2)这样的速率关系,不能作为平衡状态的标志,故a错。
b:因该反应为气体体积不等的反应,故压强不变可作为平衡状态的标志。
c:由v逆(NO)=2v正(O2),可推出v逆(NO)=v正(NO),说明已达到平衡状态。
d:由于平衡体系中全是气体,容器体积固定,故任意状态下密度不变,故d错。
(3)及时分离出NO2气体,只能使平衡向正反应方向移动,不能增大反应速率,故a错;因该反应为放热反应,适当升高温度,虽使反应速率增大,但平衡向逆反应方向移动,故b错;增大O2的浓度既能增大反应速率,又能使平衡向正反应方向移动,故c正确;催化剂只能增大反应速率,不能影响化学平衡的移动,故d错。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
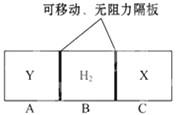
 CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如图所示。
CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如图所示。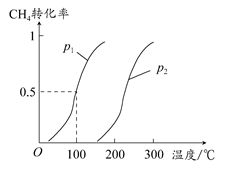
 CH3OH (g) DH1
CH3OH (g) DH1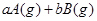

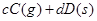
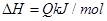 ,反应过程中,当其他条件不变时,C在混合物中的含量与温度(T)的关系如图I所示,反应速率(v)与压强(p)的关系如图II所示。据图分析,以下说法正确的是( )
,反应过程中,当其他条件不变时,C在混合物中的含量与温度(T)的关系如图I所示,反应速率(v)与压强(p)的关系如图II所示。据图分析,以下说法正确的是( )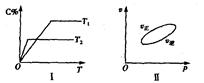
 C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)="0.100" mol/L、c(B )="0.200" mol/L及c(C )="0" mol/L。反应物A的浓度随时间的变化如图所示。
C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)="0.100" mol/L、c(B )="0.200" mol/L及c(C )="0" mol/L。反应物A的浓度随时间的变化如图所示。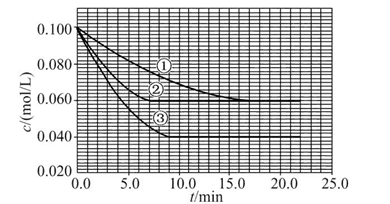
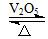 2SO3(g)是制备硫酸的重要反应。下列叙述正确的是(双选) ( )。
2SO3(g)是制备硫酸的重要反应。下列叙述正确的是(双选) ( )。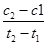
 2Z(g);△H<0,在不同温度、不同压强(p1>p2)下,达到平衡时,混合气体中Z的百分含量随温度变化的曲线应为
2Z(g);△H<0,在不同温度、不同压强(p1>p2)下,达到平衡时,混合气体中Z的百分含量随温度变化的曲线应为